Y nunca mejor dicho, pues los papeles detectores aguantan opiniones de todo tipo.
Detección colorimétrica
Los detectores colorimétricos son sistemas que emplean la «química húmeda» (término utilizado para referirse a la química general realizada en fase líquida) para poner de manifiesto la presencia de determinados agentes químicos mediante reacciones químicas que producen un cambio de color cuando los agentes entran en contacto con determinadas soluciones o sustratos. El cambio de color puede ser detectado visualmente o mediante dispositivos espectrofotométricos1.
Los tubos de detección colorimétricos, los papeles detectores o los kits de reactivos colorimétricos permiten la detección de muchos agentes químicos industriales y también de muchos agentes químicos de guerra. Los papeles detectores se emplean para la detección de agentes químicos líquidos (no en el agua), mientras que los tubos de detección colorimétricos y los kits de reactivos colorimétricos se emplean para la detección de agentes químicos en forma de gases y vapores1.
Las reacciones colorimétricas empleadas en los sistemas de detección suelen ser reacciones de tipo ácido-base, redox o de formación de complejos, bastantes estudiadas, que tienen una buena sensibilidad pero una moderada selectividad. Algunas fuentes de información señalan que los detectores colorimétricos son dispositivos de detección altamente específicos dado que responden a cierto número de sustancias químicas para las cuales fueron diseñados como detectores, con escasa o nula interferencia de otras sustancias químicas, y en consecuencia con un limitado número de falsas alarmas:
(«they are highly specific detection devices and have higher selectivity, as they respond to a certain number of specific chemicals that they were designed to detect with little or no interference from other chemicals. Consequently, the potential for false responses/alarms is limited.»2).
Ciertamente las reacciones colorimétricas se seleccionan en función de la sensibilidad y selectividad deseadas, y con ayuda de otras reacciones no colorimétricas podemos mejorar su selectividad eliminando sustancias interferentes, pero dado que su mecanismo es generalmente una reacción ácido-base, redox o de formación de complejos, la selectividad está bastante limitada y no pueden evitarse algunos falsos positivos o interferencias.
Lo que si es cierto es que la elección de una determinada reacción para la detección de un determinado grupo de sustancias químicas supone que muchas otras sustancias químicas no van a poder detectarse dado que no sufren esa reacción. Las sustancias químicas que no son detectadas y que desearíamos detectar constituyen falsos negativos. El usuario debe tener claro que tendrá que utilizar varios sistemas de detección colorimétrica si desea realizar la detección de sustancias químicas diferentes.
Los detectores colorimétricos, especialmente los tubos de detección colorimétrica, son más útiles como complemento a otras tecnologías de detección en tiempo real, para conseguir un nivel de detección confirmada2.
Papeles detectores de agentes químicos de guerra
Los papeles detectores de agentes químicos de guerra se emplean en numerosas Fuerzas Armadas desde hace muchos años pues resultan el sistema de detección más rápido, barato, ligero y sencillo para su empleo en el campo de batalla3.
Aunque algunas fuentes indican que los papeles indicadores se emplean para la detección de agentes químicos en forma líquida, o en forma de aerosol, lo cierto es que las fuentes más fidedignas indican claramente que no detectan agentes químicos en forma de vapor o aerosol, ni agentes químicos en el agua3.
Los papeles indicadores consisten en un papel sin coloración especial (sin blanquear) impregnado con uno o más colorantes (pigmentos) o colorantes indicadores (indicadores). Cuando una gota de una sustancia química (agente químico de guerra) moja el papel (es absorbida por el papel) se disuelve(n) los pigmentos mostrando su color, provocando en algunos casos un cambio en la coloración del indicador (si el papel contiene indicador). El color que se muestra indica la presencia de la sustancia química. En algún caso la aparición de diferentes colores permite clasificar la sustancia como perteneciente a un determinado grupo, pero nunca identifican la sustancia1.
La apreciación del color o de un cambio en el mismo puede resultar problemática en algunas situaciones. En primer lugar, cada persona tiene una percepción de color ligeramente diferente, e incluso algunas personas pueden sufrir algún grado de ceguera de color, lo que les impide, en algunos casos, observar ciertos cambios de color. Además, en condiciones de luz tenue o de luz muy brillante es difícil de observar los colores, lo que repercute en la efectividad del dispositivo de detección colorimétrica3.
Por su fundamento los papeles detectores tienen el inconveniente de su falta de selectividad o especificidad, que provoca la aparición de falsos positivos dado que muchas sustancias corrientes, como disolventes, líquidos de freno, anticongelantes, repelentes de insectos, etc., provocan un cambio de color. Estos falsos positivos son especialmente indeseables en situaciones civiles porque pueden llevar a situaciones de pánico. Como ya se ha indicado, es conveniente que los papeles detectores se empleen junto con otros detectores de distintas tecnologías para disminuir la presencia de falsos positivos y conseguir una detección confirmada3.
Papel detector M8/C84
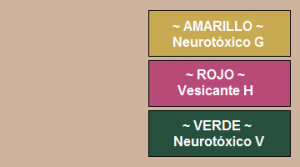
El papel detector M8 (NSN 6665-00-050-8529) fue desarrollado para detectar agentes líquidos, específicamente agentes neurotóxicos, de tipo G y de tipo V, y agentes vesicantes, de tipo H. El papel detector C8 es equivalente al papel de M8; la «C» indica que está fabricado para uso comercial (civil). Los papeles detectores M8/C8 no detectan agentes químicos en forma de vapor.
El papel detector M8 viene en forma de librillo, de aproximadamente 6 cm × 10 cm, con 25 hojas, que pueden desprenderse con facilidad dado que están microperforadas.
Una carta de colores que acompaña al librillo de papeles detectores ayuda a determinar el tipo de agente detectado. El resultado es cualitativo, pero el papel del detector tiene una sensibilidad de alrededor de 20 microlitros (μL) de líquido. Algunas sustancias, tales como insecticidas, anticongelantes y productos de petróleo, pueden actuar como interferencias y producir falsos positivos. También existe un producto similar, llamado papel «3-way», equivalente a los papeles de M8/C8, que lleva en la cara posterior del papel un adhesivo que permite pegar las hojas de papel a los materiales, equipos y EPI.
El cambio de color del papel depende del tipo de agente presente, por ejemplo los agentes vesicantes, como la iperita, HD, disuelven el colorante rojo y aparece coloración rojiza; los agentes neurotóxicos de tipo G disuelven el colorante amarillo y aparece coloración amarillenta, y los agentes neurotóxicos de tipo V disuelven en colorante amarillo pero al mismo tiempo provoca que el colorante indicador verde cambie a color azul, y aparece una coloración verdosa3.
 La norma MIL-P-51408 Military Specification «Paper, Chemical Agent Detector, VGH, ABC-M8» indica que el papel indicador M8 está impregnado con tres colorantes, en la siguiente proporción:
La norma MIL-P-51408 Military Specification «Paper, Chemical Agent Detector, VGH, ABC-M8» indica que el papel indicador M8 está impregnado con tres colorantes, en la siguiente proporción:
- Un 0,6 ± 0,2 % de colorante rojo (MIL-D-51412)
- Un 1,3 ± 0,3 % de colorante amarillo (MIL-D-51411) CAS 80234-33-9 y
- Un 1,0 ± 0,3 % de colorante verde (MIL-D-51410) CAS 5833-18-1
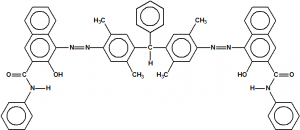
El colorante rojo es, según la MIL-D-51412, el 2,5,2′,5′-tetramethyl triphenylmethane-4,4′;-diazo-bis-beta-hydroxynaphthoic anilide. Por este nombre no aparece número CAS alguno, pero resulta que la estructura corresponde al colorante rojo E que es el 4,4′-[(phenylmethylene)bis[(2,5-dimethyl-4,1-phenylene)azo]]bis[3-hydroxy-N-phenylnaphthalene-2-carboxamide],cuyo número CAS es 60033-00-3.
2,5,2′,5′-tetramethyl triphenylmethane-4,4′-diazo-bis-beta-hydroxynaphthoic anilide
4,4′-[(phenylmethylene)bis[(2,5-dimethyl-4,1-phenylene)azo]]bis[3-hydroxy-N-phenylnaphthalene-2-carboxamide]
El colorante amarillo es, según la MIL-D-51411, el thiodiphenyl-4,4′-diazo-bis-salicylic acid, cuyo número CAS es 80234-33-9.
thiodiphenyl-4,4′-diazo-bis-salicylic acid
El colorante verde es, según la MIL-D-51410, el ethyl-bis-2,4-dinitrophenyl acetate, un indicador de pH que tiene un pKa=8,39. El intervalo de transición va de pH=7,5 (incoloro) a pH=9,1 (azul profundo). Su número CAS es 5833-18-1 y su número EINECS es 227-415-1.
ethyl-bis-2,4-dinitrophenyl acetate
Papel detector M94
El papel detector M9 (NSN 6665-01-226-5589 y NSN 6665-01-049-8982) detecta la presencia de agentes neurotóxicos y vesicantes en forma líquida mediante la aprición de una coloración rojiza. No distingue el tipo de agente, ni detecta agentes químicos en forma de vapor. Se necesita una gota de agente químico que produzca una mancha de mojado de al menos 100 micrómetros (μm) de diámetro. Sustancias interferentes que producen un falso positivo incluyen insecticidas, anticongelantes y productos de petróleo. El papel detector M9 viene en forma rollo, de 5,1 centímetros de ancho y 9,1 metros de largo, y la parte trasera del papel lleva un adhesivo que permite pegarlo a los materiales, equipos y EPI.
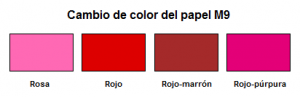 Pueden aparecer manchas en cualquier tono de rojo,
Pueden aparecer manchas en cualquier tono de rojo,
- Una persona daltónica puede ver una mancha roja como gris o negro. Las manchas deben ser controladas por una persona que no sufra daltonismo.
- Las manchas de color azul, amarillo, verde, gris o negro no son se atribuyen a la presencia de agente químico líquido
La composición del papel indicador M9 en cuanto a los colorantes ha variado con el tiempo. Parece que el colorante inicial que llevaba era el colorante B-1, esto es, el 1-[(4- nitrophenyl)azo]naphthalen-2-amine, CAS 3025-77-2 (MIL-D-51494) pero debido a su acción mutagénica y posiblemente cancerígena fue sustituido por el colorante SR119 (Solvent Red 119), CAS 12237-27-3.
Las normas MIL-P-51493 y MIL-51518 recogen la composición del papel indicador M9. La primera, de acceso público, es la que hace referencia al colorante B-1, mientras que la segunda, que no es de acceso público (es CLASSIFIED), haría referencia al colorante SR119.
Según la MIL-P-51493 y la MIL-D-51494, el papel M9 tiene en su composición:
- Un 0,8 ± 0,1 % de colorante B-1, 1-[(4- nitrophenyl)azo]naphthalen-2-amine, (CI 11385) y CAS 3025-77-2,
- Un 0,16 % de pigmento azul 15, copper phthalocyanine, (CI 74160) y CAS 147-14-8,
- Un 1,6 % de amarillo óxido de hierro, yellow iron oxide o goethite, (CI 77492) y CAS 51274-00-1, y
- Un 0,05 % de negro de humo, carbón black, (CI 77266) y CAS 1333-86-4
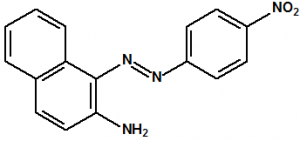
colorante B-1
1-[(4- nitrophenyl)azo]naphthalen-2-amine
Sin embargo las hojas de seguridad del papel M9 (la norma MIL-DTL-51518 es CLASSIFIED) indican una composición ligeramente distinta13:
- Un 0,17 % de colorante B-1, 1-[(4- nitrophenyl)azo]naphthalen-2-amine, (CI 11385) y CAS 3025-77-2,
- Un 0,34 % de pigmento azul 15, copper phthalocyanine, (CI 74160) y CAS 147-14-8, y
- Un 0,17 % de amarillo óxido de hierro, yellow iron oxide o goethite (CI 77492) y CAS 51274-00-1
- PAPER, CHEMICAL AGENT DETECTOR, M9 6665-01-049-8982, Anachemia Chemical Inc., http://www.hazard.com/msds/f2/brt/brtgs.html
Y al reemplazar el B-1 por el SR11914:
- Un 0,17 % de colorante solvent red119, CAS 12237-27-3 (aunque también aparece con el CAS 73297-20-8),
- Un 0,34 % de pigmento azul 15, copper phthalocyanine, (CI 74160) y CAS 147-14-8, y
- Un 0,17 % de amarillo óxido de hierro, yellow iron oxide o goethite, (CI 77492) y CAS 51274-00-1
Papel detector triple (3-way)4
El papel detector triple (3-way) es similar al papel detector M8 pero en este caso las hojas llevan en su cara posterior un adhesivo que permite pegar las hojas de papel a los materiales, equipos y EPI. La información encontrada indica que se ha sustituido alguno de los colorantes, concretamente el amarillo, simplemente sustituyéndolo por su sal sódicaal parecer por su carácter mutagénico. Según las firmas Nextteq15 y Anachemia16 la composición del papel detector triple (3-way) sería:
- Un 0,6 ± 0,2 % de colorante rojo E, CAS 60033-00-3
- Un 1,2 ± 0,4 % de colorante amarillo A2, CAS 8003-87-0
- Un 1,0 ± 0,3 % de colorante verde EDA, CAS 5833-18-1
Los colorantes rojo y verde se corresponden con los ya citados para el papel detector M8, 4,4′-[(phenylmethylene)bis[(2,5-dimethyl-4,1-phenylene)azo]]bis[3-hydroxy-N-phenylnaphthalene-2-carboxamide] y ethyl-bis-2,4-dinitrophenyl acetate, respectivamente, y el colorante amarillo A2 es el disodium 5,5′-[thiobis(phenyleneazo)]disalicylate cuyo número CAS es 8003-87-0.
colorante amarillo A2
disodium 5,5′-[thiobis(phenyleneazo)]disalicylate
Utilización17
- Los papeles detectores NO DETECTAN VAPORES de agentes químicos.
- Los papeles detectores detectan agentes químicos en ESTADO LÍQUIDO. Sitúe los papeles donde puedan entrar en contacto con la contaminación líquida
- No sitúe los papeles detectores sobre superficies calientes, sucias, aceitosas o grasientas porque puede dar un falso positivo
- Los papeles detectores pueden dar falsos positivos con algunos descontaminantes, si se emplean en zonas donde se ha realizado una descontaminación
- Puede ayudarse de otros objetos, por ejemplo un palo, para colocar el papel en su extremo y tocar de este modo con el papel sobre la posible contaminación. ¡NO FROTE EL PAPEL CONTRA LA CONTAMINACIÓN!
- Los papeles detectores dan falsos positivos con productos derivados del petróleo, amoníaco, anticongelentes, insecticidas, descontaminantes, etc.. Si observa un cambio de color hay que pensar que se trata de un agente químico. Protégase completamente, de la alarma, descontamínese (si fuese necesario) y confirma la presencia del agente químico mediante el empleo de otros medios de detección y del control visual de su entorno.
- Los papeles detectores SÓLO DETECTAN.
- Los cambios de color significativos sólo permiten una CLASIFICACIÓN DEL AGENTE.
- Los cambios de color NO SIGNIFICATIVOS no se atribuyen a la presencia de agentes químicos líquidos.
- En base al tamaño de las manchas y al número de éstas sobre el papel detector, es posible estimar el tamaño original de las gotas del agente líquido y el grado de contaminación. Una gota de líquido de 0,5 mm de diámetro genera una mancha en el papel detector de unos 3 mm de diámetro. Una gota de este tamaño por cm2 en el papel detector correspondería a una contaminación líquida en la superficie contaminada de aproximadamente 0,5 g/m2. El límite de detección en los mejores casos es del orden de 0,005 g/m2. 18
Referencias
- «Guide for the Selection of Chemical Detection Equipment for Emergency First Responders», Preparedness Directorate Office of Grants and Training, 2007, http://www.nist.gov/oles/upload/DHS_100-06ChemDetFinReport_3-20-07.pdf
- «Detection technologies for chemical warfare agents and toxic vapors», Yin Sun & Kwok Y. Ong, CRC Press
- «A Review of CWA Detector Technologies and Commercial-Off-The-Shelf Items», https://www.google.es/url?sa=t&rct=j&q=&esrc=s&source=web&cd=1&ved=0ahUKEwjP2uGJkdrMAhXD1xQKHbMVAEUQFggpMAA&url=http%3A%2F%2Fwww.dtic.mil%2Fcgi-bin%2FGetTRDoc%3FAD%3DADA502856&usg=AFQjCNFzu6LE81VHF6xJNSFTyltbXshk-g&bvm=bv.122129774,d.d24&cad=rja
- «OSHA Technical Manual-SecII Chap3- Technical Equipment-On-site Measurements-AppB-chemical warfare agent detection», https://www.osha.gov/dts/osta/otm/otm_ii/pdfs/otmii_chpt3_appb.pdf
- MIL-P-51408 Military Specification «Paper, Chemical Agent Detector, VGH, ABC-M8»
- MIL-D-51412 Military Specification «Dye, Red, 2,5,2′,5′-tetramethyl triphenylmethane-4 ,4′-diazobis-betahydroxynaphthoic anilide»
- MIL-D-51411 Military Specification «Dye, Yellow, Thiodiphenyl-4,4’-diazo-bis-salicylic acid»
- MIL-D-51410 Military Specification «Dye, Green, ethyl-bis(2,4-dinitrophenyl) acetate»
- «Handbook of Acid-Base Indicators», R. W. Sabnis, CRC Press
- MIL-D-51494 Military Specification «Dye, B-1, water dispersed formation»
- MIL-P-51493 Military Specification «Paper, Chemical Agent Detector, M9»
- MIL-DTL-51518 Military Specification «Paper, Chemical Agent Detector, M9 (SR119 Dye)»
- «M9 Detection Paper MSDS, B-1», 6665-01-049-8982, Anachemia Chemical Inc., http://www.hazard.com/msds/f2/brt/brtgs.html
- «M9 Detection Paper MSDS,SR119», 6665-01-226-5589, Anachemia Chemical Inc., http://hazard.com/msds/f2/bqk/bqkkt.html
- «M8 Detection Paper MSDS», Nextteq LLC, http://www.heinzlabs.com/msds/Chem-Agent-Detect_MSDS.pdf
- «M8 Detection Paper MSDS», Anachemia Chemicals Inc., http://hazard.com/msds/f2/bqk/bqkhl.html
- Detect Chemical Agents Using M8 or M9 Detector Paper, https://trainingnco.pbworks.com/f/031-503-1037+Detect+Chemical+Agents+Using+M8+or+M9+Detector+Paper.pdf
- «A Survey of Commercially Available Chemical Agent Instrumentation for Use in the Field», J. Haas, A. Alcaraz, B. Andresen, C. Pruneda, https://e-reports-ext.llnl.gov/pdf/242985.pdf
Nota: los nombres químicos de los colorantes se han mantenido en inglés para facilitar las búsquedas