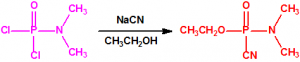
El tabún (N,N-dimetil fosforamidocianidato de O-etilo) fue descubierto accidentalmente por Gerhard Schrader el 23 de diciembre de 1936, cuando intentaba obtener el correspondiente dicianuro dimetilamidofosfórico. Al hacer reaccionar el dicloruro dimetilamidofosfórico con cianuro sódico en etanol lo que obtuvo fue el N,N-dimetil fosforamidocianidato de O-etilo, en vez de obtener el dicianuro dimetilamidofosfórico (esperaba la sustitución de los átomos de cloro por grupos cianuro)1:
Terminada la síntesis, la destilación del producto final producía un líquido claro, descolorido, con un olor débil de manzanas, que Schrader denominó preparación 9/91. Dio una pequeña muestra de la sustancia a Kükenthal, que encontró que una solución de la misma, extremadamente diluida (1:200000), era capaz de acabar por contacto con la totalidad de los pulgones. La preparación 9/91 era cien veces más potente que el compuesto original, y mucho más eficaz que cualquier otra sustancia que el grupo de investigación de Schrader hubiera desarrollado. También quedó claro que los síntomas desagradables que Schrader había experimentado en noviembre de ese mismo año habían sido causados por la exposición a esa nueva sustancia. Schrader y Kükenthal solicitaron la patente de este nuevo tipo de insecticida1.
A pesar de su olor suave y afrutado que inducía a pensar en que era algo inocuo, en enero de 1937, una pequeña gota derramada producía de nuevo en Schrader, y en su ayudante Karl Küpper, miosis y dificultades respiratorias. Schrader decidió enviar una muestra a Eberhard Gross director de higiene industrial de IG Elberfeld para la realización de estudios in vivo en animales para comprobar su toxicidad. El informe de Eberhard Gross sobre la sustancia Le-100 como así había renombrado a la preparación 9/91 (Le provenía de Leverkusen) indicaba una elevada toxicidad en humanos, que para decepción de Schrader la descartaba como insecticida1.
Un decreto nazi de 1935 requería que se informase de todo descubrimiento de interés militar, y así lo hizo la IG Farben. A instancias de Leopold von Sicherer y Wolfgang Wirth de la División 9 del Departamento de Ensayo y Desarrollo de Armas se solicitaba un informe detallado de la sustancia Le-100. Schrader describió la síntesis y propiedades del Le-100 a Leopold von Sicherer, al coronel Ernst Rüdiger von Brüning de la División 9 y a Hermann Van der Linde jefe del Laboratorio de Protección de Gas del Ejército. Estos quedaron impresionados por las propiedades del Le-100, que se convertía en el primer agente neurotóxico de guerra con el nombre de Tabun, palabra inventada sin significado alguno. No obstante para ocultar la identidad del Tabún se emplearon otros nombres en clave, como Gelan, Trilon 83 o T-83 (los trilones eran detergentes) o Stoff 100, y más tarde recibiría por los aliados el acrónimo de GA1.
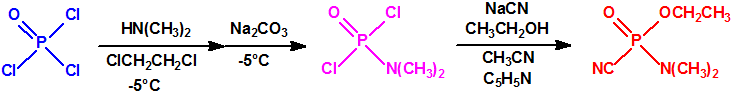
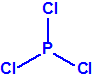
El tabún se prepara fácilmente mediante un proceso de dos etapas que comienza con la obtención del dicloruro dimetilamidofosfórico por reacción del oxicloruro de fósforo con dimetilamina, empleando 1,2-dicloroetano como disolvente y carbonato sódico para la neutralización, con enfriamiento a una temperatura de -5°C2,3. El dicloruro dimetilamidofosfórico se convierte después en tabún por reacción con cianuro de sodio y alcohol etílico en presencia de piridina, con acetonitrilo como disolvente2,3:
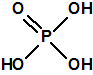
El tabún es un N.N-dialquil fosforamidocianidato de alquilo (Lista 1A.2), a diferencia de sarín, somán y ciclosarín que son alquilfosfonofluoridatos de alquilo (Lista 1A.1), y por tanto, el tabún y sus homólogos fosforamidocianidatos acabarán degradándose a ácido fosfórico, mientras que el sarín y sus homólogos alquilfosfonofluoridatos acabarán degradándose a los correspondientes ácidos alquilfosfónicos4,5.
El VX y sus homólogos, S-2-dialquil-aminoetil alquilfosfonotiolatos de alquilo (Lista 1A.3), también acaban degradándose a los correspondientes ácidos alquilfosfónicos4,5.
 |
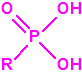 |
| Ácido fosfórico | Ácidos alquilfosfónicos |
Hidrólisis del tabún
La hidrólisis (desdoblamiento de una molécula por la acción del agua) del tabún y del sarín, así como la de sus homólogos y la de los fosforofluoridatos de dialquilo es catalizada por los ácidos y las bases (álcalis), resultando las bases más efectivas que los ácidos.6,7
A diferencia del sarin y del fluorofosfato de diisopropilo (DFP), cuyos productos de hidrólisis son independientes del catalizador utilizado, el tabún es hidrolizado de manera diferente según que el ataque se lleve a cabo por ácidos o por bases, y por ello pueden formarse diferentes productos de hidrólisis.6
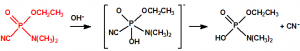
En solución alcalina, la hidrólisis rompe el enlace P-CN dando como resultado la formación de N,N-dimetilfosforamidato de O-etilo (CAS 2632-86-2) y de cianuro sódico. En solución ácida, la hidrólisis favorece la ruptura del enlace P-N, con formación de fosforocianidato de O-etilo (CAS 161935-17-7) y liberación de N,N-dimetilamina.6
Según los datos de Larsson7 y de Holmstedt8, parece que la velocidad de hidrólisis del enlace P-CN del tabún es, a efectos prácticos, independiente de la concentración de iones hidroxilo en el rango de pH de 4,0 a 8,5. La vida media del tabún en este rango de pH es de 2-4 horas a una temperatura de 20-25 °C.
La interpretación del mecanismo de hidrólisis supone que una molécula de agua ataca uno de los orbitales 3d vacantes del fósforo. Dependiendo de la acidez de la solución, el compuesto intermedio formado acepta o pierde un protón formando un ion inestable que se descompone espontáneamente para producir un compuesto estable7.
Hidrólisis ácida7
A pH moderadamente ácido (pH 3-5) la hidrólisis del tabún produce la liberación tanto de ácido cianhídrico como de N,N-dimetilamina. La ruptura del enlace P-N esta catalizada por los iones hidroxonio (H3O+) y la velocidad de hidrólisis del grupo ciano aumenta conforme aumenta el pH (catalizada por los iones hidroxilo, OH–):
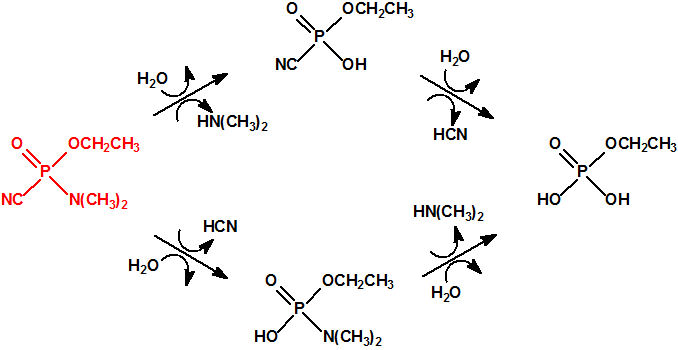
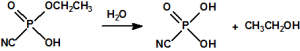
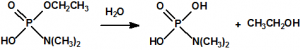
Una de las posibles rutas de hidrólisis libera en una primera etapa N,N-dimetilamina y produce fosforocianidato de O-etilo (CAS 161935-17-7), que en una posterior hidrólisis libera ácido cianhídrico y produce dihidrogenofosfato de O-etilo (CAS 1623-14-9). La otra ruta de hidrólisis comienza con la liberación de ácido cianhídrico para producir N,N-dimetil fosforamidato de O-etilo (CAS 2632-86-2), que en una posterior hidrólisis libera N,N-dimetilamina y produce también dihidrogenofosfato de O-etilo.
Parece que la hidrólisis ácida procede siguiendo ambas rutas y que el dihidrogenofosfato de O-etilo formado termina hidrolizándose en ácido fosfórico5:
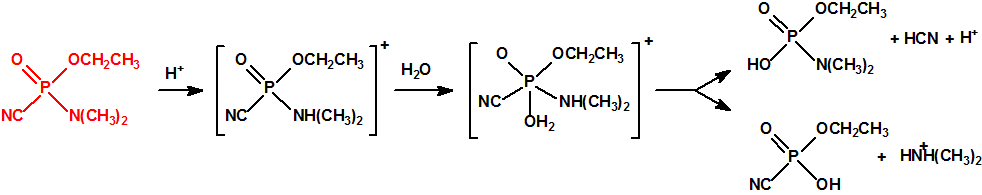
En una primera etapa, en una reacción rápida, se agrega un protón al átomo del nitrógeno del grupo amino, con lo que se anula el efecto electrómero positivo y se facilita la hidratación del átomo del fósforo. La hidratación tiene lugar lentamente y el producto hidratado intermedio se descompone lentamente por dos vías, una con liberación de ácido cianhídrico y formación de N,N-dimetil fosforamidato de O-etilo (CAS 2632-86-2), y otra con liberación de N,N-dimetilamina y formación de fosforocianidato de O-etilo (CAS 161935-17-7):
Hidrólisis alcalina7
La hidrólisis alcalina probablemente transcurre con el siguiente mecanismo:
La etapa que controla la velocidad del proceso es el ataque nucleofílico sobre el átomo de fósforo por los iones hidroxilo para formar un ion intermedio cargado negativamente, que acaba eliminando cianuro para formar N,N-dimetil fosforamidato de O-etilo (CAS 2632-86-2)
Otros productos de hidrólisis5
La hidrólisis del fosforocianidato de O-etilo (CAS 161935-17-7) también puede producir ácido fosforocianídico (CAS 25758-21-8) con liberación de etanol:
La hidrólisis del formar N,N-dimetil fosforamidato de O-etilo (CAS 2632-86-2) también puede producir ácido N,N-dimetilfosforamidico (CAS 33876-51-6) con liberación de etanol:
Incluso la hidrólisis del tabún podría, en menor extensión, afectar a su resto «éster» (en el caso del tabún, -OCH2CH3) y producir ácido N,N-dimetilfosforamidocianidico (CAS 63917-41-9), con liberación de etanol:
Referencias
- «Gerhard Schrader», J.Domingo, https://cbrn.es/?p=465
- «A Laboratory History of Chemical Warfare Agents», Jared Ledgard, Lulu.com, 2006
- «The role and control of weapons in the 1990s», Frank Barnaby, Routledge, 2012
- Convención sobre la Prohibición del Desarrollo, la Producción, el Almacenamiento y el Empleo de Armas Químicas y sobre su Destrucción (CAQ), disponible en https://www.opcw.org/fileadmin/OPCW/CWC/CWC_es.pdf y en https://www.opcw.org/fileadmin/OPCW/CWC/CWC_es.doc
- «Transportable Treatment Systems for Non-Stockpile Chemical Warfare Materiel» (Final Programmatic Environmental Impact Statement, February 2001), U.S. Department of the Army, Project Manager for Non-Stockpile Chemical Materiel, Aberdeen Proving Ground, Maryland
- «Nerve Gas in Public Water», Joseph Epstein, Public Health Reports (1896-1970), Vol. 71, No. 10 (Oct., 1956), pp. 955-962,
- «The Hydrolysis of Dimethylamido-ethoxy-phosphoryl Cyanide (Tabun)», Lennart Larsson, Acta Chem. Scand. 7 (1953) No. 2, pag. 306-314, http://actachemscand.org/pdf/acta_vol_07_p0306-0314.pdf
- «Synthesis and pharmacology of dimethylamido-ethoxy-phosphoryl cyanide (Tabun) together with a description of some allied anticholinesterase compounds containing the N-P bond», Bo Holmstedt, Acta Physiol Scand Suppl. 1951;25(90):12-120