Con la llegada del otoño las piscinas municipales de verano echarán el cierre por final de temporada. Disminuirá notablemente, la producción de cloruro de cianógeno.
Los agentes cianogénicos
El cloruro de cianógeno, ClCN, también conocido como CK, es un agente químico de guerra, de la familia de los agentes cianogénicos, recogido en el anexo sobre sustancias químicas de la Convención para la prohibición de las Armas Químicas (CAQ), en la Lista 3 (3A.2, cloruro de cianógeno, CAS 506-77-4). La Lista 3 incluye sustancias químicas tóxicas y precursores, no incluidos en las Listas 1 y 2, que en algún momento se han producido, almacenado o empleado como armas químicas y que pueden producirse en grandes cantidades comerciales para fines no prohibidos por la CAQ.1
Durante la 1ª Guerra Mundial, a finales de 1915 y principios de 1916, los franceses emplearon cianuro de hidrógeno, HCN, como agente químico de guerra. De este agente cianogénico llegaron a producir más de 3600 tm, generalmente mediante reacción de una solución concentrada de cianuro potásico con ácido sulfúrico diluido. A pesar de que el HCN es bastante tóxico y no era retenido fácilmente por el carbón de las máscaras de protección de aquel entonces, su empleo desde el punto de vista táctico deja mucho que desear, pues sus vapores son menos densos que el aire, su volatilidad resulta demasiado elevada, no presenta efectos acumulativos y la cantidad que cargaban las municiones era tan pequeña, que difícilmente se alcanzaban en el campo de batalla las concentraciones necesarias para conseguir los efectos incapacitantes o letales buscados. Además los alemanes conocedores de todo ello habían dotado a sus tropas de máscaras eficaces frente al HCN.2 El HCN también está recogido en el anexo sobre sustancias químicas de la CAQ, en la Lista 3 (3A.3, cianuro de hidrógeno, CAS 74-90-8)1.
En septiembre de 1916, los franceses introdujeron en el campo de batalla otro agente cianogénico, el cloruro de cianógeno, cuyos vapores son más densos y menos volátiles que los del cianuro de hidrógeno, y presentaban un cierto efecto acumulativo sobre los afectados. El cloruro de cianógeno era producido mediante cloración de una solución saturada de cianuro potásico a 0 °C. Su toxicidad es similar a la del HCN, pero el ClCN resulta más efectivo a bajas concentraciones (irrita los ojos y los pulmones, en un efecto tóxico retardado, similar al de los agentes sofocantes o pulmonares como el cloro y el fosgeno2. Los franceses emplearon el cloruro de cianógeno tal cual, o mezclado con tricloruro de arsénico en una composición que denominaban «Vivrite»3.
Preparación del cloruro de cianógeno
El primero en preparar cloruro de cianógeno fue el químico francés, Claude-Louis Berthollet, en 1787, mediante la acción del cloro sobre el ácido cianhídrico. Debido a su malentendido acerca de la naturaleza de cloro llamó al producto «ácido prúsico oxidado», sin llegar a determinar su constitución4.
En 1815 el químico francés Joseph Louis Gay-Lussac determinó su naturaleza química, y le asignó la fórmula ClCN, la aceptada hoy en día, asignándole el nombre de «ácido clorociánico». Para su preparación saturó con cloro una solución acuosa de ácido cianhídrico y eliminó el sobrante de cloro por agitación con mercurio. Inicialmente purificó el producto por destilación, pero luego, pensando que podría descomponerse por acción del calor, lo purificó por destilación a presión reducida. Gay-Lussac también consiguió preparar el «ácido clorociánico» mediante reacción del cloro y el ácido cianhídrico húmedo, y por la acción del cloro sobre el cianuro de mercurio seco en presencia de la luz solar4.
El francés Georges-Simon Serullas, en 1827, encontró que la presencia de humedad facilitaba enormemente la reacción entre el cloro y el cianuro de mercurio; añadía agua para humedecer, sin llegar a disolver, el cianuro mercúrico4.
En 1847 el también químico francés Charles Adolphe Wurtz trataba una solución diluida de ácido cianhídrico enfriada a 0 °C con cloro. Al cabo de algún tiempo se formaba una capa líquida en la superficie de la solución, que separada y lavada con agua, hervía a 20 °C y sus vapores ardían con una llama violeta. Llamó a este líquido «clorohidruro de cianógeno» y le asignó la fórmula 2ClCN.HCN. Este líquido, una vez enfríado y tratado con óxido de mercurio para eliminar el HCN, producía cloruro de cianógeno que se destilaba a través de de cloruro de calcio4.
Los trabajos del alemán Alexander Naumann y del suizo Emil Vogt, en 1870, demostraron que el producto que se formaba en primer lugar al pasar cloro sobre las soluciones de ácido cianhídrico no era un compuesto de cloruro de cianógeno y ácido cianhídrico, sino simplemente una mezcla, en proporciones variables, de estas dos sustancias4.
En 1850 el alemán Friedrich Wöhler preparaba cloruro de cianógeno agregando un ligero exceso de cianuro de mercurio a una solución saturada de esta sal en el agua, sobre la que pasaba luego cloro hasta saturar la solución y llenar de cloro el espacio sobre la misma. El frasco cerrado, coloca en un cuarto oscuro y se agita frecuentemente hasta que todo el cianuro se haya disuelto o todo el cloro se haya consumido. Cualquier exceso de cloro es eliminado por el mercurio, y el cloruro de cianógeno se destila luego a través de cloruro de calcio y se condensa en un tubo en forma de U refrigerado4.
En 1854, los franceses Auguste André Thomas Cahours y François Stanislas Cloez describieron un método que se diferenciaba del método de Wohler en que utilizaba una solución diluida de cianuro de mercurio (100 g en 4 litros de agua) y el cloro se eliminaba haciendo pasar los gases a través de un tubo que contenía limaduras de cobre4.
Más recientemente, en 1947, Barnett y colaboradores siguiendo una propuesta inicial de A. Held, de 1897, prepararon cloruro de cianógeno por acción del cloro, en condiciones controladas, sobre una solución de sulfato de cinc y de cianuro de sodio. Con este procedimiento conseguían cloruro de cianógeno de gran pureza y con un rendimiento cercano al 70%5.
Von Hans Schröder, en 1954, obtenía un rendimiento cercano al 100 % por reacción del cloro con una solución de K2Zn(CN)4, a temperatura ambiente6.
R. Varma y A.J. Signorelli, en 1969, obtenían cloruro de cianógeno con rendimiento cercano al 95 % por reacción a temperatura ambiente del monóxido de cloro, Cl2O, con cianuro de plata sólido7:
Propiedades del cloruro de cianógeno
El cloruro de cianógeno, ClCN, es un compuesto lineal, al igual que el cianuro de hidrógeno y los otros haluros de cianógeno (FCN, BrCN, ICN), con el cloro unido al átomo de carbono mediante un enlace simple y un triple enlace entre los átomos de carbono y nitrógeno.
Es una molécula pequeña de peso molecular 61,47 con punto de fusión de -6 °C y punto de ebullición de 13,7 °C. En condiciones normales de presión y temperatura es un gas incoloro, con un olor acre, más denso que el aire (densidad relativa de los vapores 2,16). Es muy soluble en agua, con una constante de la lay de Henry de 2,48 kPa·m3/mol que sugiere una fácil volatilización8.
El cloruro de cianógeno reacciona con el amoníaco para formar cianamida y cloruro amónico9:
Las soluciones acuosas de hidróxido de sodio o de potasio provocan su descomposición, con formación de cloruros y cianatos9:
La hidrólisis producida por los iones hidroxilo produce ácido ciánico, un ácido débil de pKa=3,4810:
La acción de los hipocloritos provoca la destrucción del cloruro de cianógeno por oxidación total a nitrógeno11:
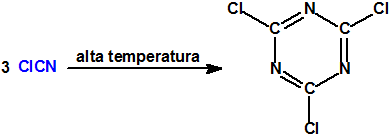
Por acción de las altas temperaturas sufre polimerización, formando triclotriazina (CAS 108-77-0), un sólido cristalino que funde a 190 °C9:
La orina
La orina es un líquido acuoso transparente y amarillento, de olor característico, secretado por los riñones y eliminado al exterior por el aparato urinario. Su constitución es compleja y variable, estando constituida fundamentalmente por un 91-96% de agua y el resto sustancias orgánicas e inorgánicas en una relación aproximada de 7 a 5. La composición de la orina depende de factores tales como la dieta, la salud y la condición física.
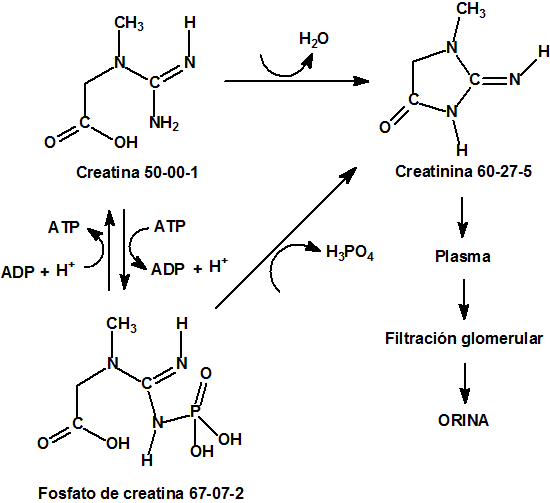
Los componentes orgánicos más importantes son la urea (CAS 57-13-6), el ácido úrico (CAS 69-93-2) y la creatinina (CAS 60-27-5) (residuo procedente del fosfato de creatina, CAS 67-07-2, o de la propia creatina, CAS 50-00-1). La urea supone aproximadamente el 95% del nitrógeno de la orina.12
Relación entre la creatina y la creatinina13
La orina artificial preparada conforme a la norma DIN EN 1616:1999 tiene un pH de 6,6 ± 0,1 y es una solución acuosa preparada con agua destilada desionizada, que contiene14:
- 25,0 g/L de urea (CAS 57-13-6),
- 2,0 g/L de creatinina (CAS 60-27-5),
- 9,0 g/L de cloruro sódico (CAS 7647-14-5),
- 2,5 g/L de hidrógeno ortofosfato disódico anhidro (CAS 7558-79-4),
- 2,5 g/L de dihidrógeno ortofosfato potásico (CAS 7778-77-0),
- 3,0 g/L de cloruro amónico (CAS 12125-02-9) y
- 3,0 g/L de sulfito sódico (CAS 7757-83-7)
ClCN en las piscinas15,16,17,18
Se ha comprobado mediante estudios por espectrometría de masas en muestras de agua de piscinas, que cuando se orina en una piscina, los compuestos que ésta contiene pueden reaccionar con el cloro activo del agua, y formar, entre otros compuestos orgánicos más o menos volátiles, ClCN, y tricloramina o tricloruro de nitrógeno (NCl3), que resultan tóxicos por inhalación.
Además estudios en laboratorio sobre la reacción de hipoclorito con los compuestos habitualmente presentes en la orina y en el sudor (urea, algunos aminoácidos como L-arginina, L-histidina, y glicina, creatinina, ácido úrico, etc.) también detectaron la formación de ClCN y de NCl3.
Las concentraciones típicas de ácido úrico en el sudor y en la orina son 0,012 y 4,54 mM, respectivamente, y si suponemos estas son las únicas fuentes de ácido úrico en las piscinas, entonces aproximadamente el 93% de ácido úrico presente en las piscinas procedería de la orina.
La formación y persistencia del ClCN depende de diversos factores tales como pH, temperatura, concentración de cloro, concentración de fluido orgánico, radiación ultavioleta, etc..
Sin embargo lo que verdaderamente condiciona la presencia o ausencia de ClCN en las piscinas son las prácticas de higiene de los bañistas. Si estos se duchan antes de entrar en las piscinas y no se orinan en ellas, la producción de ClCN se viene abajo.
Referencias
- «Convención sobre la prohibición del desarrollo, la producción, el almacenamiento y el empleo de armas químicas y sobre su destrucción», texto completo, https://www.opcw.org/sp/convencion-sobre-las-armas-quimicas/texto-completo/
- «Medical Aspects of Chemical and Biological Warfare», «Chapter 10. Cyanide Poisoning», Medical Department of the Army, F.R. Sidell, E.T.Takafuji & D.R. Franz, 1997
- «The war gases», Mario Sartori, D. Van Nostrand Company, Inc., 1939
- «The preparation of cyanogen chloride», W. L. Jennings & W. B. Scott
- «The preparation of cyanogen chloride», H. W. Barnett, R. G. Davis & R. P. Graham, Canadian Journal of Research, Vol. 25, Sec. B, 289-294, 1947.
- «Zur Darstellung von Cyanchlorid», Hans Schröder, Z. anorg. allg. Chem., 297, 5-6, Dezember 1958, 296–299
- «A new synthesis of cyanogen chloride», R. Varma & A. J. Signorelli, Inorg. Nucl. Chem. Letters, Vol. 5, pp. 1017-1019, 1969
- «Cyanogen Chloride in Drinking-water», http://www.who.int/water_sanitation_health/dwq/chemicals/phe_cyanogen_background_document.pdf
- «An outline of organic nitrogen compounds», F. Degering, University Lithoprinters, 1945
- «The hydroxide-assisted hydrolysis of cyanogen chloride in aqueous solution», E. J. Pedersen III&B.J. Mariñas, Wat. Res. Vol. 35, No. 3, pp. 643-648, 2001
- «Hydrolysis and Chlorinolysis of Cyanogen Chloride», Charles C. Price, T. E. Larson, Karl M. Beck, F. C. Harrington, L. C. Smith, Ilya Stephanoff, J. Am. Chem. Soc., 1947, 69 (7), pp 1640–1644
- «Synthetic Urine Composition», http://syntheticurineworld.blogspot.com.es/2015/12/synthetic-urine-composition.html
- «Creatine Basics and Biochemistry», Prabhat Bhama, http://umich.edu/~medfit/supplementation/creatinebasicsandbiochemistry101705.html
- «Industry Specific Artificial Urine», http://www.pickeringtestsolutions.com/artificial-urine2/
- «Volatile Disinfection Byproduct Formation Resulting from Chlorination of Organic-Nitrogen Precursors in Swimming Pools», Jing Li & Ernest R. Blatchley III, Environ. Sci. Technol. 2007, 41, 6732-6739
- «Volatile disinfection by-product analysis from chlorinated indoor swimming pools», William A. Weaver, Jing Li, Yuli Wen, Jessica Johnston, Michael R. Blatchley, Ernest R. Blatchley III, Water Research, 43 (2009), 3308-3318
- «Ultraviolet-Induced Effects on Chloramine and Cyanogen Chloride Formation from Chlorination of Amino Acids», ShihChi Weng & Ernest R. Blatchley III, Environ. Sci. Technol., 2013, 47, 4269−4276
- «Volatile Disinfection Byproducts Resulting from Chlorination of Uric Acid- Implications for Swimming Pools», Lushi Lian, Yue E, Jing Li & Ernest R. Blatchley III, Environ. Sci. Technol., 2014, 48, 3210−3217