Un día como hoy, hace 113 años nació Gerhard Schrader, considerado el padre de los pesticidas modernos y de los agentes neurotóxicos de guerra.
El 25 de febrero de 1903 nacía en Bortfeld, una pequeña localidad de la Baja Sajonia, situada a unos 60 km al este de Hannover, Paul Gerhard (Heinrich) Schrader.
Schrader creció en una familia religiosa protestante y disfrutó de una infancia agradable. Comenzó trabajando en un gimnasio en la localidad de Brunswick para después estudiar química en la Universidad Técnica de esa misma localidad. En octubre de 1928, después de completar su doctorado en ingeniería química en la Universidad de Brunswick, y con tan solo 25 años, comenzó a trabajar en un laboratorio de las fábricas de la Bayer AG en Elberfeld (estas fábricas formaban parte del gran combinado químico de la I.G. Farben que también incluía a otras cinco grandes empresas, Agfa, Chemische Fabrik Griesheim-Elektron, Chemische Fabrik vorm. Weiler Ter Meer, BASF y Hoechst que incluía a su vez Cassella y Chemische Fabrik Kalle).
En las navidades de 1928 se comprometía con Gertrud Ahlers, con la que se casaría en 1929. Un año más tarde, en 1930 nacería su primera hija Wiebke, y en abril de 1935 nacería su segunda hija Kristin.
Schrader se había especializado en química inorgánica, pero en 1930, después de pasar dos años en Elberfeld, fue transferido al principal laboratorio de investigación de la Bayer sobre tintes de naftaleno, en Leverkusen.
Cuando Otto Bayer (químico industrial, que desarrolló la primera síntesis de un poliuretano a partir de diisocianato de 1,6-hexametileno y de 1,4-butanodiol) asumió dirección de las investigaciones en 1934, le asignó la tarea de sintetizar nuevos pesticidas. En aquel momento, el Reich alemán quería liberarse de su dependencia de las importaciones extranjeras en el sector de la alimentación. Para poder lograr esto, después de la transferencia de grandes áreas en el este al terminar la I Guerra Mundial, había que aumentar los rendimientos de las cosechas. A principios de 1930, el Reich alemán había gastado 30 millones de marcos alemanes en pesticidas basados en extractos de plantas (principalmente nicotina), pero esperaba el apoyo de la industria alemana para ser independientes. Al principio, habían obtenido algunos éxitos con algunos fluoruros orgánicos, que resultaron eficaces contra el escarabajo y la polilla, pero no era suficiente.
En Leverkusen, Schrader se aplicó con energía y entusiasmo al nuevo campo de los pesticidas sintéticos. Otto Bayer encargó a Schrader la tarea de desarrollar un fumigante no inflamable que permitiera acabar con los gorgojos en los silos con grano, así como con las pulgas en los buques y salas de estar. Existía un enorme mercado potencial para un producto de ese tipo, pues por entonces los fumigantes más empleados, el formiato de etilo y el óxido de etileno, provocaban algunas veces explosiones en los silos y en otros espacios cerrados.
Los compuestos de flúor habían comenzado a atraer el interés de los químicos. Se habían sintetizado nuevos tintes que contenían flúor, los «freones» eran famosos, el fluoracetato se recomendaba para proteger la lana y ya se habían patentado algunos fluoruros inorgánicos como insecticidas. Por otra parte, a través del Departamento de química Inorgánica de la I. G. Farben se disponía de fluoruro de hidrógeno a escala industrial.
Así pues Schrader consciente de que los compuestos orgánicos que contenían flúor resultaban ser generalmente tóxicos, pensó que podrían ser buenos candidatos para nuevos insecticidas. En 1934, Schrader y su equipo comenzaron a introducir flúor en una amplia variedad de moléculas orgánicas que posteriormente Hans Kükental, biólogo de Leverkusen ensayaba para ver su actividad insecticida. Los primeros compuestos organofluorados que sintetizaron tenían un fuerte poder irritante sobre los ojos y los pulmones, lo que hacía impracticable su empleo como insecticidas. En 1935 sintetizó el 2-fluoroetanol (FCH2CH2OH) y el 2-fluoro-2´-hidroxidietil éter (FCH2CH2OCH2CH2OH) y a pesar de su toxicidad para los mamíferos, el 2-fluoroetanol fue patentado como rodenticida.
Decidió por ello enfocar la investigación sobre los compuestos orgánicos que contenían flúor y azufre. Algunas de las sustancias sintetizadas parecían ser fumigantes efectivos contra diversas plagas de insectos, pero ensayos adicionales demostraron que eran absorbidas por el grano tratado, y éste resultaba entonces inapropiado para el consumo humano. Cuando Schrader trató de aprovechar este inconveniente para desarrollar cereales tóxicos como un veneno para ratas, se encontró que las sustancias absorbidas se evaporaban gradualmente, y se reducía con el tiempo la toxicidad de los granos. Sin desanimarse por estos reveses, Schrader y sus colaboradores continuaron la síntesis sistemática de nuevos compuestos de carbono que contenían azufre como átomo central.
Aunque muchos de estos productos químicos fueron tóxicos para los insectos, ninguno cumplió con los requisitos de seguridad y estabilidad necesarios para un insecticida comercial. En 1935 Gerhard Schrader, Otto Bayer y Hans Kükenthal patentaban los alquil fluosulfonates como insecticidas, afirmando que resultaban más efectivos que sus análogos los aril fluorosulfonatos propuestos anteriormente por Willy Lange en 1930.
Sin embargo, Otto Bayer, director de investigación de I. G. Farben, estaba decepcionado por los resultados y decidió que Schrader trabajase en otros campos.
Tabún y Sarín
En el curso de un trabajo sistemático con ésteres y amidas del ácido fosfórico relacionado con el caucho sintético (también conocido como «buna») Schrader preparó varios compuestos organofosforados y envió muestras de los mismos a su colega Hans Kükenthal para que comprobase su actividad insecticida y asegurarse con ello que no se le escapaba ninguna propiedad útil de los mismos. Resultaba que algunos de estos compuestos eran altamente tóxicos, especialmente los que tenían dos grupos OH del ácido fosfórico sustituidos por sustituyentes orgánicos (tipo éster), y el otro OH sustituido un grupo ácido, por ejemplo, Cl, F, SCN, CON, etc., mientras que el doble enlace del oxígeno se mantenía o se sustituía por un átomo de azufre.
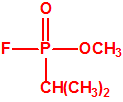
Muy probablemente Schrader debió pensar que si el fósforo, siguiente elemento al azufre en la tabla periódica presentaba propiedades químicas similares al azufre, sería de esperar que los compuestos de fósforo también fuesen como los del azufre tóxicos para los insectos. Además los trabajos realizados años antes por Willy Lange y su estudiante Gerda von Krüger cuando ésta trabajaba sobre los fluorofosfatos como parte de su tesis doctoral apoyaban este razonamiento. En 1932, en la Universidad de Berlín, Willy Lange y Gerda von Krueger sintetizaban los primeros miembros de la familia de los fosforofluoridatos de dialquilo, el fosforofluoridato de dimetilo, FP(O)(OCH3)2 y el fosforofluoridato de dietilo, FP(O)(OCH2CH3)2, y ellos mismos experimentaban sus efectos tóxicos:
«resulta interesante el fuerte efecto de los ésteres alquílicos del ácido monofluorofosfórico sobre el organismo humano. Los vapores de estos compuestos tienen un agradable olor fuertemente aromático. Pero unos minutos después de la inhalación, se siente una gran presión en la laringe, asociada con disnea. Luego se sufre una disminución de la consciencia y una hipersensibilidad dolorosa del ojo frente a la luz. Estos síntomas tardan varias horas en disminuir. Al parecer no son causados por productos ácidos de la descomposición de los ésteres y son probablemente atribuibles a los propios fosforofluoridatos de dialquilo.»
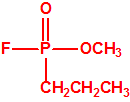
Prepararon otros homólogos, el fosforofluoridato de dipropilo y el fosforofluoridato de dibutilo y comprobaron que actuaban de igual manera, en cantidades también muy pequeñas. Lange pensó que estos compuestos podrían ser útiles para el control de plagas y se los ofreció a la I. G. Farben para su evaluación, pero la empresa en aquel momento no parecía tener mucho interés en estos temas.
Schrader y su equipo procedieron a la síntesis de diferentes compuestos de fósforo pentavalente, con sus cuatro enlaces (uno de ellos un doble enlace) unidos a diferentes átomos o grupos de átomos. Algunos de estos compuestos mostraron una buena actividad como insecticidas de contacto, por ejemplo una solución acuosa de los mismos al 0,2 % rociada sobre los pulgones de una planta acababa con todos ellos. En 1935 Gerhard Schrader and Otto Bayer presentaban en Alemania, Estados Unidos, Inglaterra y Suiza una patente sobre los difluoruros dialquilamidofosfóricos para ser utilizados como insecticidas («Dialkylaminophosphorous fluorides and a process for preparing the same«):
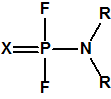 Estructura de los difluoruros dialquilamidofosfóricos, donde X corresponde a oxígeno o azufre, y R corresponde a un radical alquílico con 1-3 átomos de carbono.
Estructura de los difluoruros dialquilamidofosfóricos, donde X corresponde a oxígeno o azufre, y R corresponde a un radical alquílico con 1-3 átomos de carbono.
Schrader y su equipo emplearon mucho tiempo en la búsqueda de estructuras similares que aportasen mejores resultados, descartando los candidatos con bajo poder insecticida, mala estabilidad, bajo rendimiento sintético o dificultades de suministro en las materias primas.
Puesto que el ácido ciannhídrico tenía en su molécula el grupo ciano (-CN) y era tóxico, la incorporación de este grupo a una molécula, debería conferir a la misma las propiedades tóxicas del grupo ciano. Schrader decidió incorporar el grupo ciano a la estructura de los compuestos de fósforo con los que trabajaba.
Para ello trataba el dicloruro dimetilamidofosfórico (dimethylamidophosphoric dicloride) con cianuro sódico en etanol en un intento de obtener el correspondiente dicianuro dimetilamidofosfórico:
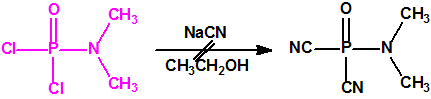 Después de realizar una primera síntesis en noviembre de 1936, él mismo comenzó a experimentar algunos efectos fisiológicos altamente desagradables, como dolor de cabeza, falta de concentración y dificultad para respirar. También notó una marcada atenuación de su campo de visión y dificultad de acomodación visual. Mirándose al espejo descubrió que sus pupilas no se dilatan como deberían en respuesta a condiciones de escasa luz. Durante los días siguientes, su estado de salud empeoró y tuvo que pasar dos semanas en el hospital antes de que su visión se recuperara completamente. Después de recibir el alta médica Schrader pasó unos días en casa de sus padres para recuperarse totalmente, y volver a su laboratorio poco antes de Navidad, para continuar la investigación de los compuestos de fósforo con cianuro.
Después de realizar una primera síntesis en noviembre de 1936, él mismo comenzó a experimentar algunos efectos fisiológicos altamente desagradables, como dolor de cabeza, falta de concentración y dificultad para respirar. También notó una marcada atenuación de su campo de visión y dificultad de acomodación visual. Mirándose al espejo descubrió que sus pupilas no se dilatan como deberían en respuesta a condiciones de escasa luz. Durante los días siguientes, su estado de salud empeoró y tuvo que pasar dos semanas en el hospital antes de que su visión se recuperara completamente. Después de recibir el alta médica Schrader pasó unos días en casa de sus padres para recuperarse totalmente, y volver a su laboratorio poco antes de Navidad, para continuar la investigación de los compuestos de fósforo con cianuro.
El 23 de diciembre de 1936, trataba el dicloruro dimetilamidofosfórico (dimethylamidophosphoric dicloride) con cianuro sódico en etanol en un intento de obtener el correspondiente dicianuro dimetilamidofosfórico. Sin embargo, el compuesto obtenido fue el N,N-dimetil fosforamidocianidato de O-etilo, más conocido como Tabun:
 Terminada la síntesis, la destilación del producto final producía un líquido claro, descolorido, con un olor débil de manzanas, que Schrader denominó preparación 9/91. Dio una pequeña muestra de la sustancia a Kükenthal, que encontró que una solución de la misma, extremadamente diluida (1:200000), era capaz de acabar por contacto con la totalidad de los pulgones. La preparación 9/91 era cien veces más potente que el compuesto original, y mucho más eficaz que cualquier otra sustancia que el grupo de investigación de Schrader hubiera desarrollado. También quedó claro que los síntomas desagradables que Schrader había experimentado en noviembre habían sido causados por la exposición a esa nueva sustancia. Schrader y Kükenthal solicitaron la patente de este nuevo tipo de insecticida.
Terminada la síntesis, la destilación del producto final producía un líquido claro, descolorido, con un olor débil de manzanas, que Schrader denominó preparación 9/91. Dio una pequeña muestra de la sustancia a Kükenthal, que encontró que una solución de la misma, extremadamente diluida (1:200000), era capaz de acabar por contacto con la totalidad de los pulgones. La preparación 9/91 era cien veces más potente que el compuesto original, y mucho más eficaz que cualquier otra sustancia que el grupo de investigación de Schrader hubiera desarrollado. También quedó claro que los síntomas desagradables que Schrader había experimentado en noviembre habían sido causados por la exposición a esa nueva sustancia. Schrader y Kükenthal solicitaron la patente de este nuevo tipo de insecticida.
A pesar de su olor suave y afrutado que inducía a pensar en que era algo inocuo, en enero de 1937, una pequeña gota derramada producía de nuevo en Schrader, y en su ayudante Karl Küpper, miosis y dificultades respiratorias. Schrader decidió enviar una muestra a Eberhard Gross director de higiene industrial de IG Elberfeld para la realización de estudios in vivo en animales para comprobar su toxicidad. El informe de Eberhard Gross sobre la sustancia Le-100 como así había renombrado a la preparación 9/91 (Le provenía de Leverkusen) indicaba una elevada toxicidad en humanos, que para decepción de Schrader la descartaba como insecticida.
Un decreto nazi de 1935 requería que se informase de todo descubrimiento de interés militar, y así lo hizo la IG Farben. A instancias de Leopold von Sicherer y Wolfgang Wirth de la División 9 del Departamento de Ensayo y Desarrollo de Armas se solicitaba un informe detallado de la sustancia Le-100. Schrader describió la síntesis y propiedades del Le-100 a Leopold von Sicherer, al coronel Ernst Rüdiger von Brüning de la División 9 y a Hermann Van der Linde jefe del Laboratorio de Protección de Gas del Ejército. Estos quedaron impresionados por las propiedades del Le-100, que se convertía en el primer agente neurotóxico de guerra con el nombre de Tabun, palabra inventada sin significado alguno. No obstante para ocultar la identidad del Tabún se emplearon otros nombres en clave, como Gelan, Trilon 83 o T-83 (los trilones eran detergentes) o Stoff 100, y más tarde recibiría por los aliados el acrónimo de GA.
A Schrader el descubrimiento del tabún le valió el reconocimiento de la IG Farben. En noviembre de 1937, a petición del Heinrich Hörlein, fue transferido de Leverkusen a un nuevo laboratorio en Elberfeld, donde continuó su investigación en el más estricto secreto. Aunque el ejército alemán ofreció dar Schrader un contrato para el desarrollo de un proceso de producción a escala industrial del tabun, Hörlein rechazó la oferta, pues la administración de la IG Farben era reacia a involucrarse en la guerra química por diversas razones (escaso beneficio económico y mala imagen). Por consiguiente, a Schrader le encomendaron se concentrase en el desarrollo de insecticidas agrícolas.
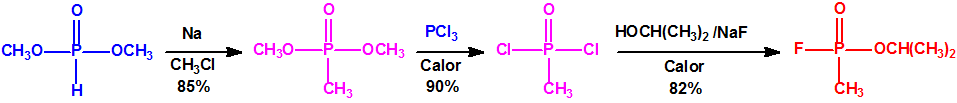
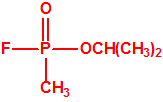
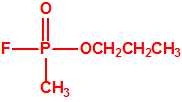
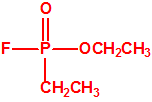
En el curso de experimentos para el intercambiar el cloro del dicloruro dimetilamidofosfórico por flúor, en presencia de alcohol con fluoruro de sodio, Schrader observó para su sorpresa que no se había obtenido el correspondiente difluoruro dimetilamidofosfórico, sino el éster dietílico del ácido fluorofosfórico, pero con un rendimiento mucho mejor que el obtenido en una síntesis diferente por Lange y Krueger. De manera que se lanzó a la tarea de sintetizar diferentes ésteres del ácido fluorofosfórico, por ejemplo, homólogos del tipo de compuestos que Lange y Krueger habían descrito en 1932-33 (entre ellos el fosfofluoridato de diisopropilo, más conocido como DFP). En agosto de 1938 Schrader y Kükenthal presentaban su patente, mantenida en secreto hasta septiembre de 1951, que a pesar de lo que algunos pudieran pensar, no se refería al sarín o compuestos similares al sarín, sino a insecticidas de ésteres del ácido fluorofosfórico.
Mientras tanto, trabajando en su laboratorio en Elberfeld, Schrader desarrolló una nueva familia de insecticidas reemplazando el grupo cianuro en Tabun con un átomo de flúor y añadiendo un enlace fósforo-carbono, donde el carbono correspondía a un grupo metilo.
A finales de 1938, Schrader sintetizó uno de estos compuestos organofosforados con fluór y un enlace P-C, que resultó ser sorprendentemente tóxico para los insectos. Las pruebas de toxicidad posteriores que Gross realizó sobre mamíferos demostraron que la nueva sustancia era de cinco a diez veces más tóxica que el tabun en perros, y dos veces más tóxica en los monos, descartándose por ello su uso como insecticida comercial. Schrader asignó a esta sustancia el código 146, y a comienzos de 1939 Gross envió su informe toxicológico a la Oficina de Guerra Alemana. Schrader tuvo que describir la síntesis y propiedades de la sustancia 146 al personal del Laboratorio de Protección de Gas del Ejército, que inmediatamente asignó un nutrido grupo de químicos para su estudio y desarrollo de un proceso de fabricación industrial.
Los oficiales del Laboratorio de Protección de Gas del Ejército denominaron a la sustancia 146 como SARIN, acrónimo derivado de las letras de los nombres de las cuatro personas claves implicadas en su desarrollo: los químicos Gerhard Schrader y Otto Ambros de la IG Farben y el coronel Ernst Rüdiger von Brüning y Hermann Van der Linde de la Oficina de Artillería del Ejército. Al igual que ocurrió con el tabún, al sarín se le asignarían diversos nombres en clave para ocultar su identidad, como Trilon 46, T144 o Gelan III, y más tarde recibiría por los aliados el acrónimo de GB.
Finalizada la II Guerra Mundial Schrader fue interrogado para ver si había estado involucrado en crímenes de guerra, quedando rápidamente absuelto. Schrader fue uno de los que más colaboró en estos interrogatorios, hasta el punto que se le ofrecería seguir trabajando en sus estudios sobre compuestos organofosforados en el Reino Unido. Schrader ya libre declinaría la oferta y seguiría trabajando en la empresa Bayer en la búsqueda de nuevos insecticidas.
Schrader siempre dedicó su talento y esfuerzos a la búsqueda de nuevos y más eficaces insecticidas, y a lo largo de su vida presentó numerosas patentes sobre pesticidas, cuyos nombres todo el mundo ha oido alguna vez, por ejemplo, el Schradan u OMPA, el pirofosfato de tetraetilo, el Bladan o TEPP, el paration, el dimefox, el paraoxon, el potasan, el cumafós, el metasystox, el disulfoton, etc.
Schrader fallecía el 10 de abril de 1990 en la localidad alemana de Cronenberg en Wuppertal, en la Renania del Norte-Westfalia.
Durante toda su vida Schrader confió en que sus investigaciones permitirían avanzar en la lucha contra el hambre en el mundo, descubrió y patentó muchos pesticidas que contribuyeron, y aún hoy contribuyen, a ello, pero por desgracia, Schrader es más conocido por su descubrimiento accidental de los agentes neurotóxicos de guerra.
Referencias
- Armas químicas: La ciencia en manos del mal, René Pita Pita, Plaza y Valdés Editores, 2008
- War of Nerves: Chemical Warfare from World War I to al-Qaeda, Jonathan Tucker, Pantheon Books, 2006
- Bayer AG: Corporate Crimes https://corporatewatch.org/company-profiles/bayer-ag-corporate-crimes
- Monofluorophosphate History, http://www.fluoride-history.de/p-mfp.htm
- Chemical warfare agents: chemistry, pharmacology, toxicology, and therapeutics, James A. Romano Jr., James A. Romano, Harry Salem, Brian J Lukey, Brian J. Lukey, Harry Salem, CRC Press, 2007
- A higher form of killing-The Secret History of Chemical and Biological Warfare, Robert Harris & Jeremy Paxman, Random House Trade Paperbacks, 1982
- Best Synthetic Methods: Organorganophosphorus (V) chemistry, Christopher M. Timperley, Elservier Ltd., 2015
- Fluorine chemistry at the millenium-Fascinated by fluorine, R.E. Banks, Elsevier Science Ltd., 2000
- The Chemistry of Organophosphorus Pesticides, C. Fest & KJ. Schmidt, Springer-Verlag, 1982