El 27 de julio de 2016, el Consejo Ejecutivo (EC), en su 52 reunión, decidió que «las armas químicas de la categoría 2 restantes se retiren de Libia con fines de destrucción fuera de su territorio en el tiempo más breve posible y no más tarde del 8 de septiembre de 2016» (EC-M-52/DEC.1, de fecha 20 de julio de 2016 y EC-M-52/DEC.2, de fecha 27 de julio de 2016).1
El 27 de agosto de 2016, comenzaron las operaciones de retirada, que concluyeron con éxito ese mismo día, de 23 tanques (cerca de 500 toneladas métricas) de armas químicas de la categoría 2 de Libia. El buque danés Ark Futura está transportando las sustancias químicas a su destino final, probablemente al puerto de Hamburgo, en Alemania, acompañado por una unidad de reacción encargada de la gestión de las consecuencias aportada por Dinamarca y sendos navíos de escolta proporcionados por España y el Reino Unido de Gran Bretaña e Irlanda del Norte.
Recordemos que Libia había declarado 26,345 toneladas de gas mostaza o iperita (armas químicas de la categoría 1) cuya destrucción concluía el 2 de mayo de 2014, y que mucho antes, el 3 de marzo de 2004, había concluido la destrucción de todo su arsenal de armas químicas de categoría 3 (3563 bombas de aviación vacías). Con respecto a sus armas químicas de categoría 2 Libia había declarado aproximadamente 1402 tm, de las cuales había podido destruir unas 689 tm (el 50,85 % de sus armas químicas de la categoría 2) antes de que la situación se complicase.2
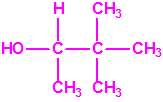
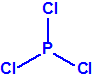
Destruidos los alcoholes isopropílico y pinacolílico, el 24 de mayo de 2016, Libia informaba a la Secretaría que había transvasado las sustancias químicas de la categoría 2 restantes (2-cloroetanol, tricloruro de fósforo, cloruro de tionilo y tributilamina) a contenedores ISO, recientemente adquiridos, como parte de los preparativos para su retirada y destrucción. Durante las operaciones de transvase, se observó que varios de los contenedores, que estaban dañados o corroídos, presentaban fugas y no contenían las cantidades declaradas, de modo que tras enmendar su declaración el arsenal Libio a destruir fuera de su territorio consistía en aproximadamente 18,045 tm de 2-cloroetanol, 238,665 tm de tributilamina, 138,770 tm de tricloruro de fósforo y 100,833 tm de cloruro de tionilo, un total de unas 496,303 tm almacenadas en 23 en contenedores ISO en perfecto estado, precintados por la OPAQ (Organización para la Prohibición de las Armas Químicas).2
 |
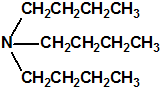 |
 |
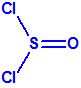 |
| 2-cloroetanol | Tributilamina | Tricloruro de fósforo | Cloruro de tionilo |
Armas químicas de la categoría 2 restantes, a destruir fuera de Libia
La destrucción fuera de Libia3
Alemania es el Estado Parte que se hará cargo de la destrucción de las armas químicas de la categoría 2 restantes de Libia, en las instalaciones de la empresa GEKA en Munster.
Está previsto llevar a cabo el proceso de destrucción en cuatro fases que pueden ser concurrentes:
fase I – destrucción del 2-cloroetanol (CH2ClCH2OH)
fase II – destrucción de la tributilamina (N(CH2CH2CH2CH3)3)
fase III – destrucción del tricloruro de fósforo (PCl3)
fase IV – destrucción del cloruro de tionilo (SOCl2)
El 2-cloroetanol será destruido por descomposición térmica en la planta de incineración «Munster-1», mientras que la tributilamina será destruida también por descomposición térmica, pero en la planta de incineración «Munster-2», que emplea un horno de combustión con tecnología de arco de plasma.
El incinerador opera a una temperatura de combustión de 800-1000 °C y se complementa con una unidad catalítica de oxidación. Bajo estas condiciones el 2-cloroetanol produce CO2 , H2O y HCl, de modo que al final se genera un residuo acuoso no-peligroso de cloruro sódico:
CH2ClCH2OH + 3½ O2 → 2 CO2 + 2 H2O + HCl ΔcH0líquido = -1191,41 kJ/mol4
Para asegurar la destrucción completa de todos los compuestos relevantes y el cumplimiento de todos los requisitos legales medioambientales, se coloca después del incinerador una unidad térmica de postcombustión.
La tributilamina será destruida por descomposición térmica empleando un horno de combustión con tecnología de arco de plasma y una unidad «denox» para tratamiento de los gases resultantes (la unidad «denox» reemplaza la necesidad de una unidad catalítica de oxidación), de modo que los productos finales de reacción consisten en CO2 , H2O y N2:
2 N(CH2CH2CH2CH3)3 + 37½ O2 → 24 CO2 + 27 H2O + N2 ΔcH0líquido = -8299,2 kJ/mol5
En un proceso «denox» (reducción catalítica selectiva, SCR) se introduce amoníaco en el reactor, en forma de mezcla NH3/aire para promover la reducción de los óxidos de nitrógeno cuando los gases entran en contacto con el catalizador6:
4 NO + 4 NH3 + O2 → 4 N2 + 6 H2O
6 NO2 + 8 NH3 → 7 N2 + 12 H2O
Los gases calientes se enfrían hasta una temperatura de unos 70 °C y se hacen pasar a través de depuradores ácidos y caústicos, así como por un precipitador electrostático y un filtro de carbón activo.
El tricloruro de fósforo (PCl3) y cloruro de tionilo (SOCl2) serán neutralizados mediante hidrólisis alcalina, y los hidrolizados sufrirán después el consiguiente proceso de destrucción (probablemente incineración, como sucedió con el hidrolizado de la iperita siria).
Debido al carácter exotérmico de todo el proceso, se requiere una apropiada refrigeración y un buen control de la temperatura en el reactor. El PCl3 y el SOCl2 se adicionan lentamente al reactor, que se alimenta también con H2O y NaOH, y la mezcla se agita vigorosamente y se refrigera hasta completar la hidrólisis.
Completada la hidrólisis el hidrolizado se ajusta a pH=7 mediante la adición de NaOH o de HCl, y si fuese necesario, se añade peróxido de hidrógeno (H2O2) para asegurar una oxidación completa.
El PCl3 reacciona rápida y exotérmicamente con agua para formar ácido fosforoso, H3PO3 y ácido clorhídrico, HCl, y la reacción con hidróxido sódico genera las correspondientes sales sódicas. Todo indica que en condiciones estequiométricas o en un exceso de agua, se generan tres moles de ácido clorhídrico y un mol de ácido fosforoso por cada mol de tricloruro de fósforo, con un calor de reacción de -289,2 kJ/mol considerando la formación de HCl en medio acuoso (el HCl tiene un elevado calor de disolución en agua)7:
PCl3 + 3 H2O → H3PO3 + 3 HCl
H3PO3 + 3 HCl + 6 NaOH → Na3PO3 + 3 NaCl + 6 H2O
El cloruro de tionilo reacciona con agua para formar dióxido de azufre y ácido clorhídrico, en una reacción también fuertemente exotérmica, y la reacción con hidróxido sódico genera las correspondientes sales sódicas:
SOCl2 + H2O → 2 HCl + SO2
SO2 + H2O2 → H2SO4
2 HCl + H2SO4 + 4 NaOH → 2 NaCl + Na2SO4+ 4 H2O
Una vez vacíos los contenedores ISO serán descontaminados y sometidos a una limpieza especial con un triple enjuagado (agua caliente y detergentes) para asegurar así la ausencia de cualquier contaminante residual.
Referencias
- «Destruction of Libya’s remaining chemical weapons», OPCW, EC-M-52/DEC.1, de fecha 20 de julio de 2016, https://www.opcw.org/fileadmin/OPCW/EC/M-52/en/ecm52dec01_e_.pdf
- «Libia quiere lo mismo que Siria», J.Domingo, https://cbrn.es/?p=664
- «Arrangement between the Organisation for the Prohibition of Chemical Weapons and the Government of Germany governing on-site inspections at the Gesellschaft zur Entsorgung von chemischen Kampfstoffen und rüstungsaltlasten MBH (GEKA MBH) Munster, and at the port of disembarkation in Germany»EC-M-53/DEC.2, de 26 de agosto de 2016, https://www.opcw.org/fileadmin/OPCW/EC/M-53/en/ecm53dec02_e_.pdf
- Popoff, M.M.; Schirokich, P.K., Ein Calorimeter zum Verbrennen von Chlor- und Bromderivaten, Z. Phys. Chem. (Leipzig), 1933, 167, 183-187
- Lebedeva, N.D., Heats of combustion and formation of aliphatic tertiary amine homologues, Russ. J. Phys. Chem. (Engl. Transl.), 1966, 40, 1465-1467
- «DENOX – flue gas denitrification», http://www.idreco.com/uk_denox.asp
- A detailed reaction study of phosphorus trichloride and water, G.A. Melhem &D.Reid, Process Safety Progress 17(1):49 – 60Spring 1998