En la noche del 12 al 13 de julio de 1917, el Ejército alemán lanzaba proyectiles cargados con una nueva arma química en el preludio de la tercera Batalla de Ypres. El ataque causó más de 2.000 bajas entre las tropas británicas. Los alemanes habían almacenado grandes cantidades de estos proyectiles químicos marcados con una cruz amarilla, con el fin de realizar una dura campaña contra los aliados en el saliente de Ypres.
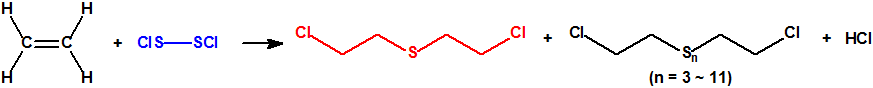
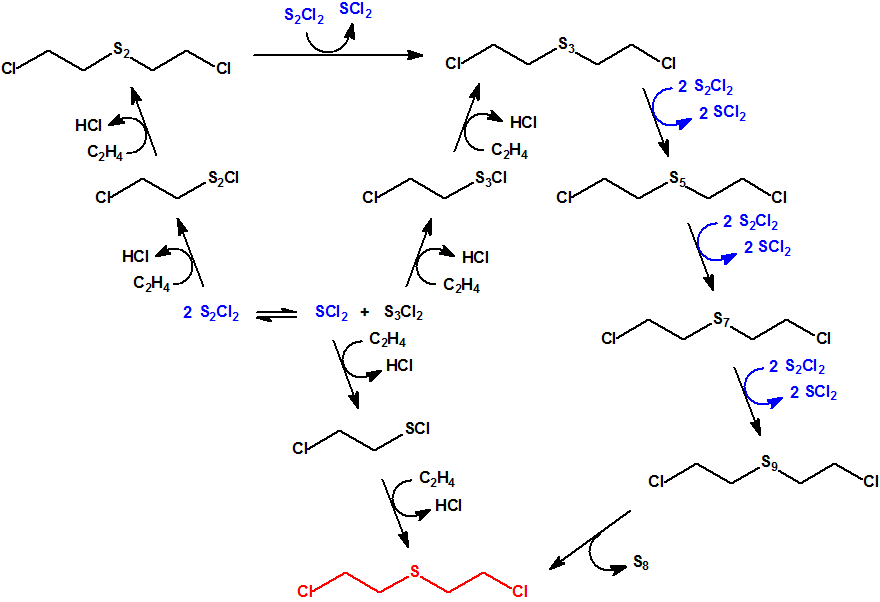
El nuevo agente químico, el sulfuro de bis(2-cloroetilo), pasó a conocerse como iperita, en referencia a su empleo en Ypres, y como «gas mostaza», por el olor de los vapores que describían los combatientes próximos a las zonas donde se producía la detonación de la munición. Sin embargo, la iperita no es un gas a temperatura ambiente sino un líquido que se evapora lentamente, persistiendo un tiempo considerable en la zona afectada.
La iperita se sintetizó por primera vez en el siglo XIX, pero no fue hasta la Primera Guerra Mundial, entre 1916 y 1917, cuando dos químicos alemanes, Lommel y Steinkopf, desarrollaron un proceso de producción a gran escala. Ya en 1915, el Centro de Porton Down en el Reino Unido había barajado su uso como arma química, pero sería rechazada por no considerarla suficientemente letal. Enfadados por la decisión, los científicos británicos que habían trabajado en el programa colocaron una gota de iperita en la silla del director del centro, quien no podría sentarse durante un mes debido a la lesión que le produjo.
Hasta la incorporación de los proyectiles de iperita en la Primera Guerra Mundial, las armas químicas empleadas consistían en bombonas para la dispersión de gases, como el cloro o el fosgeno, y proyectiles cargados con líquidos muy volátiles, como el difosgeno, que una vez inhalados tenían un efecto sofocante y que persistían poco en la zona en la que eran empleados. Desde el 22 de abril de 1915, cuando los alemanes emplearon por primera vez esta táctica, la máscara de gas formaba parte del pertrecho habitual de los combatientes de todos los bandos.
Pero la iperita no solo producía lesiones en las vías respiratorias, sino también en la piel, de ahí que el empleo de las máscaras no proporcionara protección suficiente. Los primeros equipos para la protección corporal tardaron en estar disponibles, y solo para un pequeño número de tropas especializadas en labores de descontaminación. Un contratiempo añadido era que los efectos no se manifestaban hasta pasadas varias horas, de manera que el personal expuesto no era consciente de estar en contacto con una sustancia tóxica. Pasado ese tiempo, aparecían las dolorosas ampollas en la piel que causaban la incapacitación de la persona. Esto entrañaba un problema grave, ya que un combatiente incapacitado, al contrario que uno muerto, requería de evacuación y tratamiento médico, consumiendo recursos logísticos materiales y personales.
Según los registros del Ejército británico, aproximadamente un 80% de los iperitados podía volver a su puesto entre 4 y 8 semanas después de la exposición. Hubo incluso tropas que decidían autolesionarse para evitar continuar en combate y que buscaban intencionadamente exponerse a la iperita, hecho que consideraban mejor alternativa que dispararse en una pierna o en un brazo. Un soldado canadiense iperitado en Ypres describía sus síntomas como una «agradable y suave peste» en comparación con los que padecían sus compañeros heridos por munición convencional.
La eficacia de la iperita en los ataques alemanes hizo que se ganase el título de «rey de los gases» y que los Ejércitos aliados iniciaran los preparativos para su empleo. El propio Adolf Hitler en Mein Kampf narra cómo en un ataque británico, en octubre de 1918, sufrió sus efectos cuando servía como mensajero en el 16º Regimiento de Infantería Bávaro de Reserva. Sin embargo, este hecho ha sido puesto en tela de juicio por algunos historiadores.
A lo largo de la Primera Guerra Mundial se utilizaron unas 12.000 toneladas de iperita y las armas químicas, en general, causaron más de 1,3 millones de bajas, incluidas 100.000 víctimas mortales. Si bien el uso de armas químicas no fue decisivo en el resultado final de la guerra, sí lo fue en muchas batallas. Además, no solo hay que tener en cuenta el número de bajas físicas que provocaron, sino los importantes efectos psicológicos que tenían sobre los combatientes, así como la disminución de su operatividad al tener que utilizar la máscara de protección.
Finalizada la guerra, los servicios de guerra química y la industria de EE. UU., Francia y el Reino Unido iniciaron una campaña para fomentar la idea de que el arma química era el arma del futuro. Se llegaron incluso a poner en marcha campañas publicitarias para intentar explicar que las armas químicas eran más «humanas» que las convencionales, con absurdos mensajes sobre sus supuestos usos pacíficos, como la eficacia de la iperita para tratar la tuberculosis.
La iperita pasó a ser el principal agente de los arsenales químicos de todos los países que decidieron poner en marcha programas con esta nueva arma. No resulta, por tanto, extraño que se emplease en distintos conflictos armados, como fueron los casos de España en la guerra del Rif en la década de 1920, Italia en Etiopía entre 1935 y 1936, y Japón contra China desde 1938. En el teatro de operaciones europeo de la Segunda Guerra Mundial todos los bandos estaban preparados para el empleo de armas químicas, pero tenían recelo de ser los primeros en emplearlas por el riesgo de contraataques similares, un claro ejemplo de su importante poder disuasorio. Aun así, se dieron casos puntuales en los que algunos mandos militares, sin autorización de sus superiores, decidieron emplear armas químicas en situaciones tácticas desesperadas.
Durante la Guerra Fría, la producción y almacenamiento de iperita continuó, sobre todo en las grandes potencias. Se denunció su empleo en la guerra civil de Yemen del Norte a mediados de los años 60 y, entre 1983 y 1988, Irak utilizó 1.800 toneladas en la guerra contra Irán, donde las armas químicas causaron más de 45.000 bajas. Con la entrada en vigor de la Convención de Armas Químicas en 1997, se declararon, a nivel mundial, unas 18.000 toneladas de iperita de un total de 70.000 toneladas de armas químicas. Gracias a este tratado internacional, a fecha de hoy, un 95% de los arsenales químicos declarados ya han sido destruidos, aunque cuatro países –Corea del Norte, Egipto, Israel y Sudán del Sur–, algunos de ellos sospechosos de poseer armamento químico, todavía no se han adherido a la Convención.
A pesar de los importantes logros conseguidos por la Convención en el desarme y la no proliferación, la amenaza química no ha desaparecido. A los recientes ataques químicos en Siria hay que añadir el interés que el terrorismo yihadista ha mostrado por acceder a este tipo de armamento. De hecho, procedimientos para sintetizar iperita ya se probaron en los antiguos campos de entrenamiento de Al Qaeda en Afganistán y siguen apareciendo en publicaciones electrónicas vinculadas al terrorismo yihadista. Estos métodos han sido heredados por el Daesh para llevar a cabo ataques en Irak y Siria desde el año 2014. Si bien la mala calidad de la iperita obtenida no permite causar un elevado número de víctimas, el que continúen empleándola deja claro que el terrorismo yihadista es consciente de su importante efecto psicológico para desmoralizar a las tropas y para provocar miedo y pánico entre la población. Todo esto apunta a que, después de cien años, el reinado de la iperita aún no ha finalizado.
El teniente coronel René Pita es jefe del Departamento de Defensa Química de la Escuela Militar de Defensa NBQ.
El teniente coronel (reserva) Juan Domingo es especialista en Defensa NBQ y editor de la página web cbrn.es.