La reacción de obtención del sulfuro de bis(2-cloroetilo), más conocido como iperita o gas mostaza (CAS 505-60-2), haciendo borbotear etileno seco (CAS 74-85-1) sobre monocloruro de azufre (CAS 10025-67-9) a 35 °C, y posterior destilación del material resultante, se conoce generalmente como proceso Levinstein, y en menor medida como reacción de Levinstein.1,2,3
El producto producido mediante este proceso contiene normalmente hasta un 70% de sulfuro de bis(2-cloroetilo), y aproximadamente un 30% de polisulfuros de bis(2-cloroetilo)4,5, desde trisulfuro a nonasulfuro4, dependiendo de las condiciones bajo las cuales se lleva a cabo la reacción (temperatura, grado de agitación, velocidad de adición del etileno, características del monocloruro de azufre5.
Las mostazas de azufre
En la noche del 11 de julio de 1917, los alemanes bombardearon a las tropas inglesas de Ypres con proyectiles químicos marcados con una cruz amarilla y cargados con un nuevo tipo de agresivo, de fuerte olor a mostaza. El sulfuro de bis(2-cloroetilo), utilizado como agente vesicante pasó a conocerse como iperita (derivado de Ieper, nombre en flamenco de Ypres), o gas mostaza (por el fuerte olor a mostaza de los vapores y aerosoles, aunque en condiciones normales de temperatura la sustancia está en forma líquida)1,2,4,6,7
La iperita fue descubierta por César-Mansuete Despretz8, 9,10,11 en 1822, preparada por la reacción entre el cloruro de etileno y el azufre. Después de Despretz, la iperita también fue preparada por Alfred Riche8,9,10,12 en 1854 y más adelante Frederick Guthrie8,9,10,13 en 1860, cuando éste último estudiaba los productos de condensación resultantes de la reacción de los compuestos halogenados de azufre con las olefinas. Más tarde, en 1896, Viktor Meyer8,9,10,14 preparaba la iperita por cloración del tiodiglicol (Lista 2B.13, CAS 111-48-8) con tricloruro de fósforo (Lista 3B.6, CAS 7719-12-2).
También se ha preparado iperita mediante la cloración del tiodiglicol con cloruro de hidrógeno, HCl, (Hans Thacher Clarke8,9,10,15 en 1913), con cloruro de tionilo, SOCl2 (Lista 3B.14, CAS 7719-09-7), (Wilhelm Steinkopf8,9,10,16 en 1920) y con monocloruro o dicloruro de azufre, SCl (Lista 3B.12, CAS 10025-67-9) y SCl2 (Lista 3B.13, CAS 10545-99-0), (Lundin8,9,10,17)
Mediante el método de Meyer y Stephen8,9,10,18, puede obtenerse iperita con un rendimiento de casi el 98 %, rociando una mezcla constituida por 75 partes de S2Cl2 y 25 partes de SCI2 en una atmósfera de etileno.
El sulfuro de bis(2-cloroetilo), iperita, gas mostaza o «cruz amarilla» («Gelbkreuz»), también se conoce como «LOST»» o «S-LOST» después de que el ingeniero químico alemán Wilhelm Lommel (1877-1962), y el químico, también alemán, Georg Wilhelm Steinkopf (1879-1949) desarrollaran en 1915 un procedimiento industrial para su obtención. Los americanos que obtenían el sulfuro de bis(2-cloroetilo), mediante el proceso Levinstein también lo denominaron, agente «H» cuando el producto estaba sin purificar y agente «HD» cuando el producto había sido purificado por destilación.19,20
Los agentes químicos clasificados como agentes vesicantes por su acción fisiopatológica se subdividen normalmente en tres grandes grupos20,21:
- Las mostazas de azufre (recogidas en la Lista 1A.4, con un total de nueve sustancias químicas)
- Las lewisitas (vesicantes con arsénico, recogidas en la Lista 1A.5, tres sustancias químicas) y
- Las mostazas de nitrógeno (recogidas en la Lista 1A.6, tres sustancias químicas)
El proceso Levinstein
Durante la I Guerra Mundial los alemanes utilizaban para la obtención del sulfuro de bis(2-cloroetilo) el método de Meyer, consistente básicamente en la cloración del tiodiglicol22:
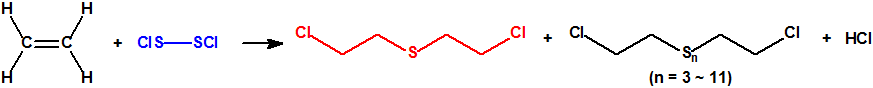
![]() Los aliados utilizaban el método de Guthrie, consistente básicamente en hacer reaccionar el etileno gaseoso con cloruro de azufre22:
Los aliados utilizaban el método de Guthrie, consistente básicamente en hacer reaccionar el etileno gaseoso con cloruro de azufre22:
![]()
![]() El procedimiento utilizado, primero por los americanos, y más tarde por los aliados, y conocido como proceso Levinstein, se llevaba a cabo en un recipiente cilíndrico de unos 100 cm de diámetro y unos 130 cm de altura, de chapa de acero o hierro fundido, forrado con plomo, dotado de un sistema de refrigeración, y provisto de un agitador. Un tubo introducido a través de la tapa del recipiente, llegaba hasta casi el fondo del mismo y permitía la introducción del etileno gaseoso. Se llenaba el recipiente con suficiente monocloruro de azufre como para cubrir el extremo del tubo, y luego se hacía borbotear etileno, ajustando la velocidad de borboteo y el sistema de refrigeración para mantener la temperatura de reacción de la mezcla entre 30- 35 °C. A medida que la reacción progresaba se iba añadiendo más monocloruro de azufre en pequeñas porciones. Para unos 430 kg de etileno, se requerían unos 750 kg de cloruro de azufre, y la reacción se completaba en aproximadamente 20 horas. Al final de la reacción el producto se extraía mediante sifón a un decantador donde se eliminaba el azufre22.
El procedimiento utilizado, primero por los americanos, y más tarde por los aliados, y conocido como proceso Levinstein, se llevaba a cabo en un recipiente cilíndrico de unos 100 cm de diámetro y unos 130 cm de altura, de chapa de acero o hierro fundido, forrado con plomo, dotado de un sistema de refrigeración, y provisto de un agitador. Un tubo introducido a través de la tapa del recipiente, llegaba hasta casi el fondo del mismo y permitía la introducción del etileno gaseoso. Se llenaba el recipiente con suficiente monocloruro de azufre como para cubrir el extremo del tubo, y luego se hacía borbotear etileno, ajustando la velocidad de borboteo y el sistema de refrigeración para mantener la temperatura de reacción de la mezcla entre 30- 35 °C. A medida que la reacción progresaba se iba añadiendo más monocloruro de azufre en pequeñas porciones. Para unos 430 kg de etileno, se requerían unos 750 kg de cloruro de azufre, y la reacción se completaba en aproximadamente 20 horas. Al final de la reacción el producto se extraía mediante sifón a un decantador donde se eliminaba el azufre22.
En 1920, Conant, Hartshorn y Richardson estudiaron el mecanismo de reacción entre el etileno y el cloruro de azufre, y postularon la formación del cloruro de (2-cloroetil)sulfenilo (CAS 26650-04-4) como una sustancia intermedia en la obtención del sulfuro de bis(2-cloroetilo), pero no consiguieron aislarla23:![]()
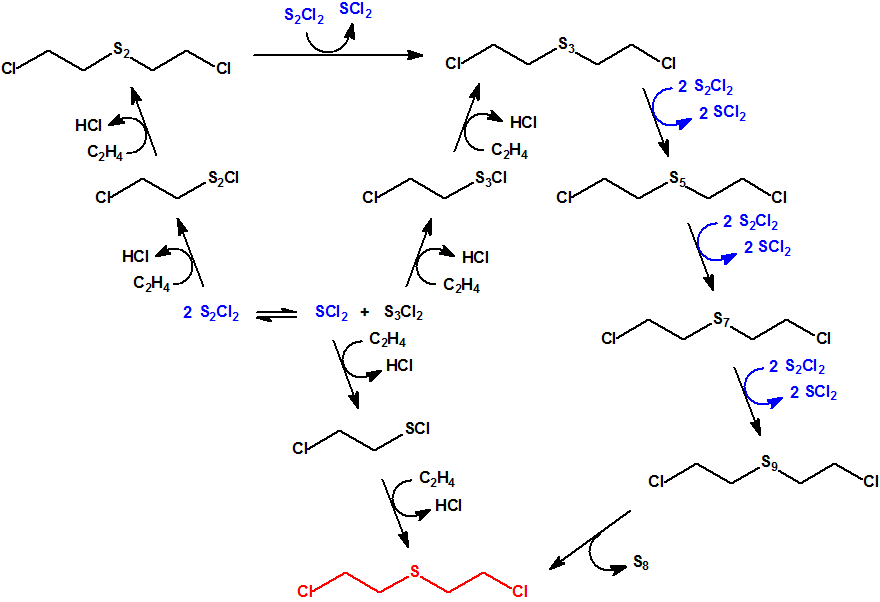
![]() El siguiente diagrama muestra el mecanismo de intercambio propuesto entre los distintos sulfuros y polisulfuros del proceso Levinstein1, con la participación de los diferentes cloruros de azufre y del cloruro de (2-cloroetil)sulfenilo :
El siguiente diagrama muestra el mecanismo de intercambio propuesto entre los distintos sulfuros y polisulfuros del proceso Levinstein1, con la participación de los diferentes cloruros de azufre y del cloruro de (2-cloroetil)sulfenilo :
El cloruro de (2-cloroetil)sulfenilo reacciona rápidamente con azufre para producir una mezcla de productos que incluyen monocloruro de azufre, S2Cl2, disulfuro de bis(2-cloroetilo), (ClCH2CH2)2S2, y trisulfuro de bis(2-cloroetilo), (ClCH2CH2)2S3.2,24
![]() Las reacciones más interesantes del cloruro de (2-cloroetil)sulfenilo son aquellas que tiene con las olefinas, especialmente con el etileno. Cuando se hace borbotear etileno sobre cloruro de (2-cloroetil)sulfenilo puro, no hay reacción. Sin embargo, si el cloruro de (2-cloroetil)sulfenilo se disuelve en tetracloruro de carbono, el etileno reacciona muy rápidamente, con desprendimiento de calor y formación del sulfuro de bis(2-cloroetilo). Este resultado corroboraría la hipótesis de Conant, Hartshorn y Richardson de que el cloruro de (2-cloroetil)sulfenilo es un producto intermedio en el proceso de obtención del sulfuro de bis(2-cloroetilo) por reacción del etileno con los cloruros de azufre.2
Las reacciones más interesantes del cloruro de (2-cloroetil)sulfenilo son aquellas que tiene con las olefinas, especialmente con el etileno. Cuando se hace borbotear etileno sobre cloruro de (2-cloroetil)sulfenilo puro, no hay reacción. Sin embargo, si el cloruro de (2-cloroetil)sulfenilo se disuelve en tetracloruro de carbono, el etileno reacciona muy rápidamente, con desprendimiento de calor y formación del sulfuro de bis(2-cloroetilo). Este resultado corroboraría la hipótesis de Conant, Hartshorn y Richardson de que el cloruro de (2-cloroetil)sulfenilo es un producto intermedio en el proceso de obtención del sulfuro de bis(2-cloroetilo) por reacción del etileno con los cloruros de azufre.2
La falta de reacción en ausencia de disolvente se atribuye al hecho de la baja solubilidad del etileno en el cloruro de (2-cloroetil)sulfenilo puro. Algo similar se observa en la reacción de etileno con monocloruro de azufre; la reacción es muy lenta a menos que se utilice un disolvente o se añada una «semilla» que inicie la reacción.2,25
La formación de polisulfuros se debe a la desproporción molecular del monocloruro de azufre en azufre dicloruro de azufre y dicloruro de triazufre; el último reacciona con etileno para formar trisulfuro de bis(2-cloroetilo) (CAS 19149-77-0) y otros polisulfuros de bis(2-cloroetilo). Al aumentar la temperatura de la reacción (por ejemplo, a 60 °C), la producción de sulfuro de bis(2-cloroetilo) se incrementa hasta un 80% y aparecen inmediatamente depósitos de azufre; a temperaturas más bajas (por ejemplo, a 20 °C), la producción de sulfuro de bis(2-cloroetilo) baja al 61%, y el azufre aparece en el sulfuro de bis(2-cloroetilo) al cabo de varias semanas.5
La Lista 1A.4 de la CAQ, «Mostazas de azufre», recoge 9 sustancias químicas consideradas «mostazas de azufre», incluida la iperita, pero no recoge ninguna de las «mostazas de azufre» consideradas impurezas en el proceso Levinstein:
La ausencia en las Listas de la CAQ de los polisulfuros de bis(2-cloroetilo) probablemente se deba a su débil poder vesicante. La siguiente tabla recoge el poder vesicante de varias mostazas de azufre, algunas recogidas en las Listas de la CAQ (en rojo) y otras no (en negro)26:
De todos los productos y subproductos que aparecen en el proceso Levinstein, sólo el sulfuro de bis(2-cloroetilo), CAS 505-60-2 y Lista 1A.4, el monocloruro de azufre, CAS 10025-67-9 y Lista 3B.12 , y el dicloruro de azufre, CAS 10545-99-0 y Lista 3B.13, están recogidos en el anexo sobre sustancias químicas de la CAQ.
Referencias
- «392-Levinstein Process», Comprehensive Organic Name Reactions and Reagents, Zerong Wang, John Wiley & Sons, Inc, 2010, pags. 1747-1749
- «Levinstein mustard gas-I-2-haloalkylsulfenyl halides», R.C. Fuson, C. C. Price, R. A. Bauman, O. H. Bullitt, W. R. Hatchard & E. W. Maynert, J. Org. Chem., 1946, 14, 469-474.
- «Levinstein mustard gas-V-The action of chlorine and sulfur chlorides on the bis(2-chloroethyl)polysulfides», R. C. Fuson, D. M. Burness, R. E. Foster & R. D. Lipscomb, J. Org. Chem., 1946, 11, 499-503.
- «Levinstein mustard gas-IV-The bis(2-chloroethyl) polysulfides», R. C. Fuson, C. C. Price, D. M. Burness, R. E. Foster, W. R. Hatchard & R. D. Lipscomb, J. Org. Chem., 1946, 11, 487-498.
- «Levinstein mustard gas-VI-The mode of formation», R. C. Fuson, R. E. Foster, & R. D. Lipscomb, J. Org. Chem., 1946, 11, 504-509.
- «The Polysulfides in Levinstein Process Mustard Gas», R. Macy, G. N. Jarman, A. Morrison & E. Emmet Reid, Science, 1947, 106, 355-359.
- «Levinstein mustard gas-III-The structure of the monochlorination product of mustard gas», R. C. Fuson & W. E. Parham, J. Org. Chem., 1946, 11, 482-486.
- «Mustard Gas-Its Pre-World War I History», R. J. Duchovic & J.A. Vilensky, J. Chem. Educ., 2007, 84 (6), p 944-948
- ¿El ácido sulfúrico, precursor de la iperita?, J. Domingo, https://cbrn.es/?m=201610
- «Chemistry and Toxicology of Sulphur Mustard-A Review», R.C. Malhotra, K. Ganesan, K. Sugendran & R.V. Swamy, Defence Science Journal, vol 49, No 2, April 1999, pp. 97-116
- «Sulphur mustard preparation and properties», César-Mansuete Despretz, Annales de Chimie et de Physique, 1822, 21, 428.
- «Recherches sur des combinaisons chlorées dérivées des sulfures de méthyle et d’éthyle», M. Alfred Riche, Annales de Chimie et de Physique, 1855, 43(3), 283-304.
- «On some derivatives from olefines», F.G. Guthrie, Quart. J. Chem. Soc., 1860, 12, 116 & 1861, 13, 129-35.
- «Weitere Studien zur Kenntnis der Thiophengruppe», V. Meyer, Dtsch. Chem. Ges., 1986,19: 628–632.
- » 4-Alky-1:4-thiazans», Hans Thacher Clarke, J. Chem. Soc., 1912, 101, 1583-90.
- «Über das Thiodiglykolchlorid und einige abkömmlinge desselben», Wilhelm Steinkopf, Julius Herold & Joseph Stöhr, Chemische Berichte, 1920, 53, 1007-12.
- «Verification of dual-use chemicals under the Chemical Weapon Convention: The case of thiodiglycol», S.J. Lundin, Oxford University Press, UK, 1991.
- «Über thiodiglykolverbindungen», V. Meyer, Chemische Berichte, 1886, 19, 3259-65.
- «Medical Aspects of Chemical and Biological Warfare», «Chapter 7. Vesicants», F. R. Sidell, E. T. Takafuji, & D.R. Franz, Walter Reed Army Medical Center, 1977.
- «Toxicología cutánea y sistémica de los agentes vesicantes de guerra», Pita y S. Vidal-Asensi, Actas Dermosifiliogr. 2010;101(1):7–18
- «Convención sobre la Prohibición del Desarrollo, la Producción, el Almacenamiento y el Empleo de Armas Químicas y sobre su Destrucción (CAQ)», disponible en https://www.opcw.org/fileadmin/OPCW/CWC/CWC_es.pdf y en https://www.opcw.org/fileadmin/OPCW/CWC/CWC_es.doc
- «The War Gases: Chemistry and Analysis», M. Sartori, Van Nostrand, New York, 1939.
- «The mechanism of the reaction between ethylene and sulfur chloride», J. B. Conant, E. B. Hartshorn, G. O. Richardson. J. Am. Chem. Soc. , 1920, 42 (3), pag 585–595.
- «The composition of mustard gas made by the Levinstein process», Kinnear, A. M. and Harley-Mason, J., J. Soc. Chem. Ind., London, Trans. & Commun., 1948, 67, 107-110.
- «XXXIV-beta,beta’-Dichloroethyl Sulphide», C. S. Gibson & W. J. Pope, J . Chem. Soc., 117, 271 (1920).
- «8. New organic sulphur vesicants-Part II-Analogues of 2,2′-dichlorodiethyl sulphide and 2,2′-di-(2-chloroethylthio)diethyl ether», A. H. Williams & F. N. Woodward, J. Chem. Soc., 1948, 38-42
Muchas gracias Srs, Pita y Domingo por compartir.