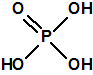
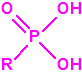
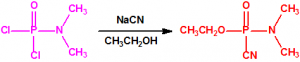
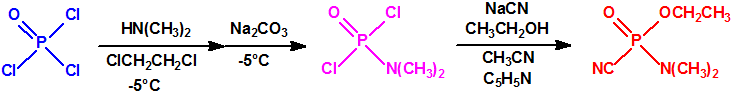
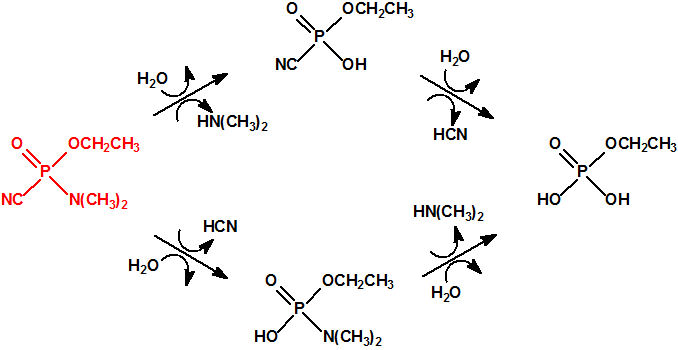
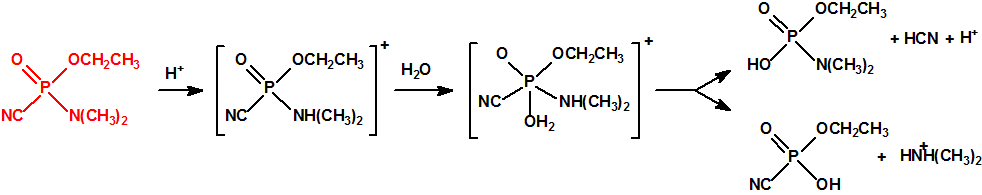
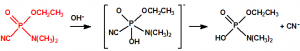
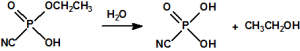
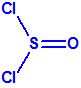
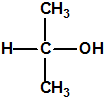
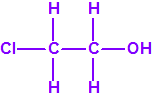
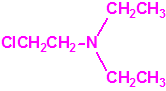
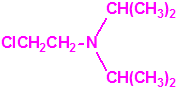
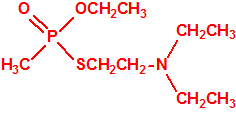
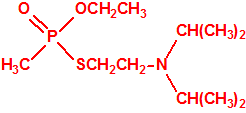
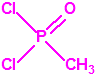
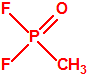
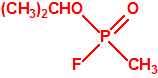
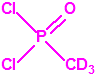
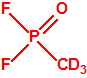
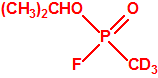
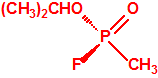
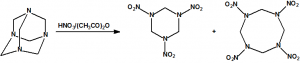
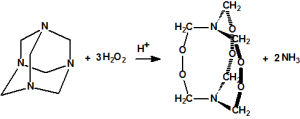
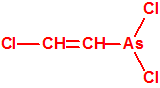El que más y el que menos recuerda, de sus matemáticas de la infancia, lo que era la intersección de dos conjuntos: «La intersección de dos conjuntos A y B es el conjunto A ∩ B que contiene todos los elementos comunes de A y B». Pues bien utilizando cinco sistemas de detección diferentes vamos a estudiar la intersección de los mismos, y veremos que la intersección no identifica.
El caso
Un especialista en Defensa NBQ, bien pertrechado que diría yo, dispone para su trabajo de cinco sistemas de detección, comprobados antes de su empleo y en perfecto estado de funcionamiento:
- Tubos de detección de ésteres fosfóricos, para agentes neurotóxicos de guerra, por ejemplo de Dräger, NSN 6665-01-518-0509
- Papel detector M8, por ejemplo de Luxfer Magtech Inc., NSN 6665-00-050-8529
- Detector de fotoionización, por ejemplo, ppbRAE 3000, NSN 6665-01-610-5755
- Detector fotométrico de llama, por ejemplo, AP2C de Proengin, NSN 6665-14-487-5893
- Detector de espectroscopía de movilidad iónica, por ejemplo, LCD-3.3 de Smiths Detection, NSN 6665-01-529-7408
Nota: NSN es el acrónimo de Nato Serial Number
El marrón que tiene que resolver es determinar si el contenido de un frasco es o no un agente químico de guerra, pudiendo emplear para ello la información proporcionada por uno, varios, o todos los sistemas de detección de que dispone:

Tubos de detección de ésteres fosfóricos
Existen en el mercado tubos detectores capaces de medir en el aire más de 200 gases y vapores orgánicos e inorgánicos. Los tubos detectores son tubos de vidrio rellenos de una serie de sustancias apropiadas que reaccionan con un determinado gas o vapor para producir un cambio o aparición de color. Para su funcionamiento emplean una bomba manual (de fuelle o de pistón) para introducir en el tubo indicador un determinado volumen de aire, establecido por el fabricante, de modo que con el cambio de color producido se puede estimar de manera semi-cuantitativa la concentración de la sustancia detectada.
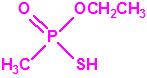
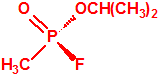
Lo primero y más importante es seleccionar el tubo detector capaz de detectar la sustancia de nuestro interés, en este caso disponemos para la detección de agentes neurotóxicos de guerra, de tubos de detección de ésteres fosfóricos, dado que los primeros son también ésteres fosfóricos.
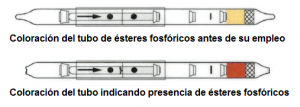
Comprobado el sistema de aspiración (sistema de bombeo), se toma un tubo y se abre por sus extremos con ayuda de la cuchilla cerámica que se suministra. Se coloca el tubo en la dirección indicada por la flecha y se sigue el procedimiento indicado por el fabricante. Por ejemplo, para los tubos de ésteres fosfóricos de la empresa Dräger (Referencia 6728461, NSN 6665-01-518-0509) sería el siguiente:
Realizar 10 emboladas de 100 mL → romper la ampolla interior del tubo → mojar con el líquido liberado la zona que contiene la enzima → esperar 1 minuto → aspirar el líquido sólo hasta marca anular → esperar 1 minuto → realizar 1 embolada adicional → la aparición de un color rojo, persistente durante al menos 1 minuto, indica presencia de agentes neurotóxicos (el tiempo necesario para realizar el ensayo es del orden de 5 minutos).
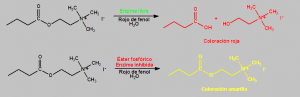
Las reacciones que pueden ocurrir dentro del tubo son las siguientes:
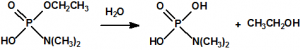
- En ausencia de ésteres fosfóricos la enzima está activa, actúa sobre el yoduro de butirilcolina (CAS 2494-56-6) y produce ácido butírico (CAS 107-92-6) y ioduro de colina (CAS 17773-10-3). El ácido butírico provoca el cambio de color del indicador acido-base rojo de fenol, y aparece coloración amarilla en el tubo indicador (pH<6,8).
- En presencia de ésteres fosfóricos la enzima está inhibida, no puede actuar sobre el yoduro de butirilcolina, y el indicador ácido-base rojo de fenol provoca la aparición en el tubo indicador de una coloración roja (pH>8,4).
Papel detector M8
Los papeles indicadores consisten en un papel sin coloración especial (sin blanquear) impregnado con uno o más colorantes (pigmentos) o colorantes indicadores (indicadores). Cuando una gota de una sustancia química (agente químico de guerra) moja el papel (es absorbida por el papel) se disuelve(n) los pigmentos mostrando su color, provocando en algunos casos un cambio en la coloración del indicador (si el papel contiene indicador). El color que se muestra indica la presencia de la sustancia química. En algún caso la aparición de diferentes colores permite clasificar la sustancia como perteneciente a un determinado grupo, pero nunca identifican la sustancia.
El papel detector M8 (NSN 6665-00-050-8529) fue desarrollado para detectar agentes líquidos, específicamente agentes neurotóxicos, de tipo G y de tipo V, y agentes vesicantes, de tipo H.
El cambio de color del papel depende del tipo de agente presente, por ejemplo los agentes vesicantes, como la iperita, HD, disuelven el colorante rojo y aparece coloración rojiza; los agentes neurotóxicos de tipo G disuelven el colorante amarillo y aparece coloración amarillenta, y los agentes neurotóxicos de tipo V disuelven en colorante amarillo pero al mismo tiempo provoca que el colorante indicador verde cambie a color azul, y aparece una coloración verdosa.
Sobre un tira de papel indicador M8 se añaden unas pequeñas gotas del líquido desconocido, que moja el papel indicador M8, disuelve el indicador amarillo, y aparece una coloración amarilla que indica presencia de agente neurotóxico de tipo G.
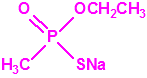
El metilfosfonato de dimetilo (DMMP) y el hidróxido sódico (NaOH) cuando mojan el papel indicador M8 también producen coloración amarilla (y por supuesto muchas otras sustancias químicas).

Detector de fotoionización
Los detectores de fotoionización (PID, PhotoIonization Detector) se utilizan para la detección no específica de una amplia variedad de sustancias químicos, en particular hidrocarburos. Los PIDs son útiles para localizar la fuente de contaminación, o para ver gradientes de concentración en una zona, porque su lectura es proporcional a la concentración de contaminantes presentes. Los PIDs, sin embargo, no pueden identificar la sustancia química contaminante presente y tampoco puede distinguir si hay uno o más contaminantes
Los PIDs utiliza la energía ultravioleta (UV) de una lámpara para ionizar las sustancias químicas presentes en el aire. Las moléculas cargadas se recogen en un electrodo colector, que genera una corriente eléctrica que sería directamente proporcional a la concentración de la sustancia presente en el aire muestreado.
El potencial de ionización (PI) de una sustancia química es la cantidad de energía necesaria para inducir la ionización de la misma. Si la energía de la lámpara UV es mayor o igual a la IP de la sustancia química que está siendo muestreada, la sustancia química podrá ser ionizada y podrá detectarse. Los PIDs pueden ser configurados con lámparas de diferentes energías. Las energías típicas de las lámparas comerciales son 9,5 eV, 10,6 eV y 11,7 eV.
Cuanto mayor sea la energía de la lámpara, mayor es el número de sustancias químicas que pueden ser detectadas. La mayor parte de los agentes químicos de guerra pueden detectarse con la lámpara de 10,6 eV (sarín, somán, tabún, ciclohexilsarin, VX, iperita, HN1, Lewisita 1, etc), así como otras sustancias químicas de interés (arsina, DMMP, fosfato de trietilo, salicilato de metilo, etc.). Se requiere una lámpara de 11,7 eV para el fosgeno y su oxima, pero el HCN y ClCN no pueden detectarse, ni tampoco ni tampoco algunas sustancias químicas industriales tóxicas, tales como HCl, HF, CO, CO2, SO2, etc.
El detector ppbRAE 3000 equipado con una lámpara de 10,6 eV, cuando se expone a los vapores de nuestra sustancia desconocida, rápidamente produce una señal intensa. Aunque nos indica una elevada concentración de isobutano, no es porque haya detectado isobutano, ni porque haya identificado isobutano, es porque ha detectado algo que se ioniza con la lámpara de 10,6 eV, y tenemos seleccionado en el equipo el factor de respuesta del isobutano.

Detector fotométrico de llama
Un detector fotométrico de llama mide la radiación emitida por los átomos de una muestra, previamente excitados por el calor de una llama aire-hidrógeno (se alcanzan temperaturas del orden de 2000-2050 °C). La muestra de aire a analizar se aspira mediante un sistema de bombeo (80 L/h) y se lleva a un mechero donde con ayuda de un suministro de hidrógeno (1,9 L/h) se quema en una llama. En la llama se produce la disociación de las moléculas y la creación de un vapor atómico, a continuación los átomos absorben energía de la llama para pasar a un estado excitado y luego al enfriarse emiten radiación característica en forma de líneas de emisión, finas y bien definidas.
La técnica permite un análisis cualitativo y cuantitativo. La variable cualitativa es la longitud de onda de las líneas emitidas, que permite la identificación de elementos, mientras que la variable cuantitativa es la intensidad de las líneas espectrales.
El diseño básico denominado AP2C (Appareil Portatif de Contrôle de Contamination) permite la detección y la estimación de la concentración de fósforo o/y azufre. Utiliza un filtro para la línea de emisión del fósforo (P-OH) a 526 nm y un filtro para la línea de emisión del azufre (S2) a 394 nm. En su pantalla se muestran las dos líneas de medida, a la izquierda la del fósforo (G,V) y a la derecha la del azufre (HD,V), en dos series de 5 indicadores que indican el nivel de concentración. Si se enciende sólo la del fósforo podemos pensar que éste fósforo se debe a la presencia de agentes neurotóxicos, bien de la familia G o bien de la familia V, dado que todos ellos tienen fósforo en su molécula. Si se enciende la línea del azufre podemos pensar que este azufre se debe a la presencia de mostazas de azufre o a la presencia de agentes neurotóxicos de la familia V, pues todos ellos tienen azufre en su molécula. Finalmente si se encienden simultáneamente tanto la línea del fósforo como la del azufre podemos pensar que esto se debe a la presencia de agentes neurotóxicos de la familia V, pues todos ellos tiene átomos de fósforo y de azufre en su molécula.
El límite de detección es de 10 µg/m3 para el sarín, y de 400 µg/m3 para la iperita.
Pero recuerde:
- El AP2C sólo detecta átomos, fósforo o/y azufre. No puede distinguir los agentes químicos de guerra de otras sustancias químicas.
- El AP2C puede distinguir entre agentes neurotóxicos de la familia G y las mostazas de azufre, y también entre agentes neurotóxicos de las familia G y de la familia V.
- El AP2C no puede distinguir entre sustancias químicas individuales y mezclas, ni si se trata de precursores, agentes químicos o productos de degradación.


En el caso que nos atañe el detector dan una señal intensa en la línea G (del fósforo), indicando la presencia de átomos de fósforo en la muestra.
Detector de espectroscopía de movilidad iónica
La espectrometría de movilidad iónica (IMS, Ion Mobility Spectrometry), también conocida como electroforesis en fase gaseosa o cromatografía de plasma, es una técnica analítica de separación de iones en fase gaseosa, donde las moléculas de interés (en este caso agentes químicos de guerra) son convertidas en agregados iónicos, de mayor masa y mayor estabilidad, que son separados, en base a su menor movilidad y difusividad, por la acción de un campo eléctrico. Los diferentes iones tardan tiempos diferentes en recorrer bajo la acción del campo eléctrico y el flujo de un gas el tubo de separación (tubo de deriva); estos tiempos dependen de la carga, masa, tamaño y forma de los diferentes iones.
La espectrometría de movilidad iónica caracteriza las sustancias químicas en función de la movilidad de sus iones gaseosos pudiéndose emplear para el análisis cualitativo y cuantitativo de sustancias químicas tóxicas, explosivos y drogas, tanto en el campo como en el laboratorio. En cierto modo es similar a la espectrometría de masas – tiempo de vuelo (TOF-MS, Time Of Flight–Mass Spectrometry), con la diferencia que la separación se produce a presión atmosférica, lo que simplifica notablemente la instrumentación y permite conseguir buena sensibilidad, rapidez de respuesta, bajo coste, robustez y portabilidad con una aceptable resolución.
La ionización se realiza mediante intercambio de carga por colisión, o por reacción ión-molécula, de modo que los iones resultantes (moléculas cargadas) tienen baja energía y son estables. Los agentes neurotóxicos (tabún, sarín, somán, VX, etc.), son ésteres fosfóricos, tienen una gran afinidad protónica y forman iones positivos; en cambio los agentes sofocantes, cianogénicos y vesicantes, son por lo general muy electrofílicos y forman iones negativos; los explosivos también suelen formar iones negativos:
- Agregados iónicos positivos
M + [(H2O)nH]+ → [(M)(H2O)mH]+ + (n-m)H2O
M + [(M)(H2O)mH]+ → [(M)2H]+ + mH2O
- Agregados iónicos negativos
M + [(H2O)nO2]– → [M]– + nH2O + O2
M + [(H2O)nO2]– → [(M)O2]– + nH2O
M + [(H2O)nO2]– → [(M)(H2O)m]– + (n-m)H2O + O2
Si tenemos interés en analizar tanto iones positivos, como iones negativos, hay que recurrir a cambiar las polaridades del tubo analizador, o a emplear dos tubos, uno con polaridad positiva y otro con polaridad negativa.
El sistema de ionización suele emplear una fuente radiactiva, pero también se puede emplear una descarga en corona o una lámpara de foto-descarga ultravioleta. Las fuentes radiactivas tienen como ventajas que emiten continuamente, no necesitan suministro de potencia, no tienen componentes electrónicos, y no requieren mantenimiento. Como desventaja tienen su radiactividad (el 63Ni es un emisor de partículas β (e– ) con un período de semi-desintegración 92 años y el 241Am es un emisor de partículas ∝ (2He2+) con un período de semi-desintegración 458 años) que dificulta su gestión y las convierte en residuos peligrosos.
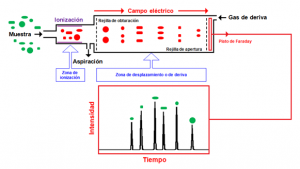 La muestra se aspira de manera continua y se introduce en la zona de ionización donde tiene lugar la formación de los iones. A continuación la rejilla de obturación introduce los iones en la zona de desplazamiento o de deriva, donde por la acción de un campo eléctrico y con la circulación de un gas de deriva que circula en contracorriente, los iones se separan y alcanzan el detector, normalmente un plato de Faraday, y se obtiene un «espectro de movilidad iónica» con la intensidad en las ordenadas y el tiempo en las abscisas. El fabricante ha establecido unas «ventanas de detección» (tiempos de desplazamiento o deriva de los iones) o «librerías» para los compuestos de su interés, y cuando alguna sustancia química genera iones que caen dentro de estas ventanas salta la alarma indicando que se ha producido una detección.
La muestra se aspira de manera continua y se introduce en la zona de ionización donde tiene lugar la formación de los iones. A continuación la rejilla de obturación introduce los iones en la zona de desplazamiento o de deriva, donde por la acción de un campo eléctrico y con la circulación de un gas de deriva que circula en contracorriente, los iones se separan y alcanzan el detector, normalmente un plato de Faraday, y se obtiene un «espectro de movilidad iónica» con la intensidad en las ordenadas y el tiempo en las abscisas. El fabricante ha establecido unas «ventanas de detección» (tiempos de desplazamiento o deriva de los iones) o «librerías» para los compuestos de su interés, y cuando alguna sustancia química genera iones que caen dentro de estas ventanas salta la alarma indicando que se ha producido una detección.
El tamaño de las «librerías» está relacionado con la resolución del sistema, de modo que cuanto mejor sea la resolución mayor podrá ser el tamaño de la «librería».
Cuanto más pequeñas sean las «librerías», menos probabilidad de falsos positivos y más probabilidad de falsos negativos (¡El sistema parece funcionar mejor pero podría no detectarse la presencia de un agente químico de guerra! )
Cuanto más grandes sean las «librerías», menos probabilidad de falsos negativos y más probabilidad de falsos positivos (¡El usuario está más protegido pero el sistema tiene más falsas alarmas! )

La alarma indicando «G» tan sólo indica que un ión ha alcanzado la ventana de tiempo (tiempo de deriva) establecida para el sarín, GB, pero hay muchas sustancias químicas que pueden generar iones que alcancen esta misma ventana. De ninguna manera se ha identificado sarín.
El conjunto intersección de conjuntos
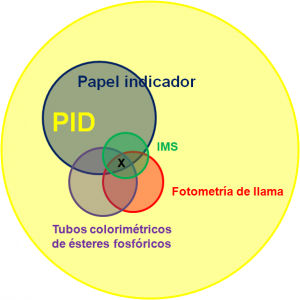
La figura trata de representar el conjunto intersección de conjuntos, donde cada círculo vendría a representar de manera imaginaria las sustancias que puede detectar, y la sustancia X pertenecería al conjunto intersección de conjuntos, indicándose con ello que todos ellos son capaces de detectar esa sustancia.
Resultado
- El líquido contenido en el frasco es un éster organofosforado (los agentes neurotóxicos de guerra lo son), pues da positivo al tubo colorimétrico de ésteres fosfóricos (agentes neurotóxicos de guerra). NO IDENTIFICA.
- El papel indicador M8 indica que se trata de un agente neurotóxico de guerra de tipo G, pues el papel cambia de color de manera nítida y toma color amarillo dorado. CLASIFICA pero NO IDENTIFICA.
- El ppbRAE 3000 con una lámpara de 10,6V da una respuesta rápida y clara. Los agentes neurotóxicos de guerra pueden ser ionizados por esta lámpara y por tanto pueden detectarse con este equipo. NO IDENTIFICA.
- El AP2C da una respuesta rápida y clara en la línea del fósforo, indicando que el líquido contenido en el frasco contiene ÁTOMOS de FÓSFORO.
- El LCD-3.3 da una alarma clara y rápida de GB, indicando que un agregado iónico de carga positiva con una movilidad iónica similar a la del GB (sarín) ha sido «DETECTADO» al estar incluida en la librería de agentes químicos de guerra. Los detectores basados en espectroscopía de movilidad de iones NO IDENTIFICAN.
Todos los detectores son congruentes en su respuesta de modo que el líquido contenido en el frasco pertenece al conjunto intersección de los cinco conjuntos, pero por mucho más que el especialista en Defensa NBQ quiera empujar, no se llega nada más que a una DETECCIÓN CONFIRMADA de un agente neurotóxico de tipo G.
 ¡La intersección no identifica!
¡La intersección no identifica!
Referencias
«Dräger-Tubes & CMS Handbook», 16th ed., http://www.draeger.com/sites/assets/PublishingImages/Master/Oil_and_Gas/Upstream/9092086-Tubes-e-low.pdf
«El papel lo aguanta todo», J.Domingo, https://cbrn.es/?p=515
«Testing of Commercially Available Detectors Against Chemical Warfare Agents: Summary Report», Terri L. Longworth, Juan C. Cajigas, Jacob L. Barnhouse, Kwok Y. Ong, & Suzanne A. Procell, http://www.chem-bio.com/resource/1999/dp_detectors_summary.pdf
«Chemical-Warfare-Agent-Measurements-By-PID», Technical Note TN-159, RAE Systems, http://www.raesystems.com/sites/default/files/content/resources/Technical-Note-159_Chemical-Warfare-Agent-Measurements-By-PID_03-06.pdf
«Using-PIDs-In-Terrorist-Chemical-Attacks», Application Note 216, RAE Systems, http://www.raesystems.com/sites/default/files/content/resources/Application-Note-216_Using-PIDs-In-Terrorist-Chemical-Attacks_04-01.pdf
«LCD 3.2E Lightweight Chemical Detector», Smiths Detection, http://www.vianas.pt/fotos/produtos/LCD3.2E_Brochura.pdf
«A Review of Chemical Warfare Agent (CWA) Detector Technologies and Commercial-Off-The-Shelf Items», Rodi Sferopoulos, https://www.google.es/url?sa=t&rct=j&q=&esrc=s&source=web&cd=1&ved=0ahUKEwiRzfCM6aTNAhUJ2BoKHWvqCm4QFggcMAA&url=http%3A%2F%2Fwww.dtic.mil%2Fcgi-bin%2FGetTRDoc%3FAD%3DADA502856&usg=AFQjCNFzu6LE81VHF6xJNSFTyltbXshk-g&bvm=bv.124272578,d.d2s&cad=rja
«Detection technologies for chemical warfare agents and toxic vapors», Yin Sun & Kwok Y. Ong, CRC Press
«Guide for the Selection of Chemical Detection Equipment for Emergency First Responders», Preparedness Directorate Office of Grants and Training, 2007, http://www.nist.gov/oles/upload/DHS_100-06ChemDetFinReport_3-20-07.pdf
«Detection technologies for chemical warfare agents and toxic vapors», Yin Sun & Kwok Y. Ong, CRC Press
«A Review of CWA Detector Technologies and Commercial-Off-The-Shelf Items», https://www.google.es/url?sa=t&rct=j&q=&esrc=s&source=web&cd=1&ved=0ahUKEwjP2uGJkdrMAhXD1xQKHbMVAEUQFggpMAA&url=http%3A%2F%2Fwww.dtic.mil%2Fcgi-bin%2FGetTRDoc%3FAD%3DADA502856&usg=AFQjCNFzu6LE81VHF6xJNSFTyltbXshk-g&bvm=bv.122129774,d.d24&cad=rja