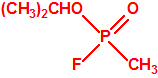
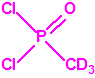
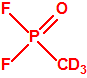
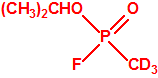
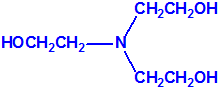
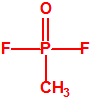
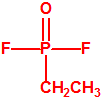
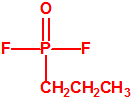
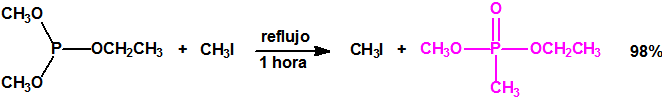
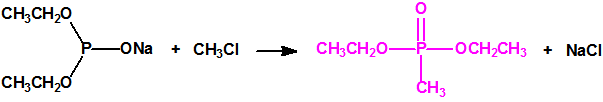
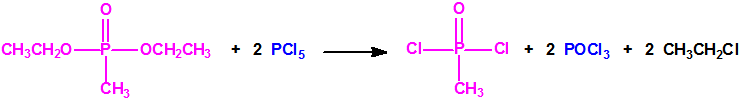
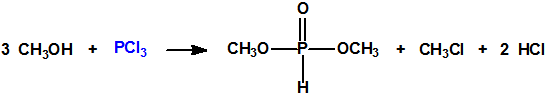
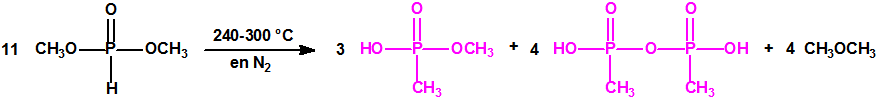
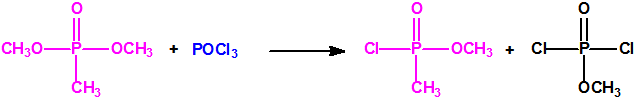
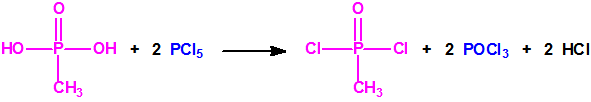
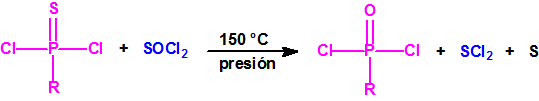
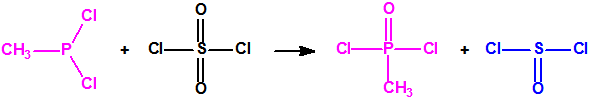
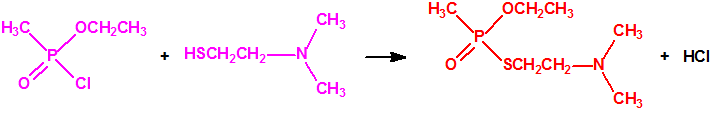
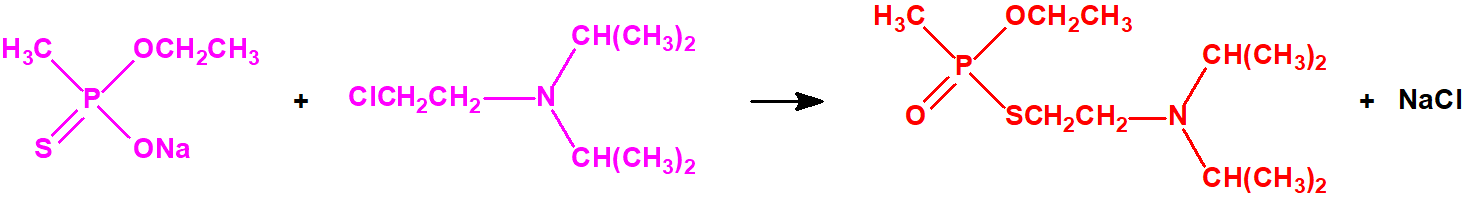
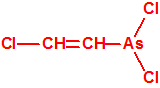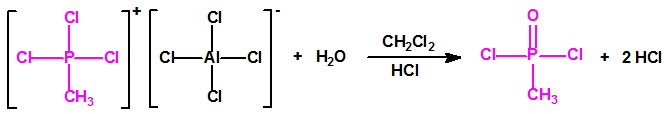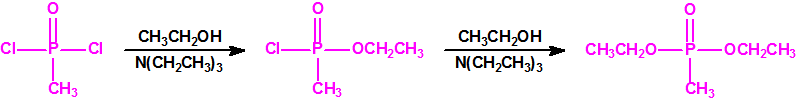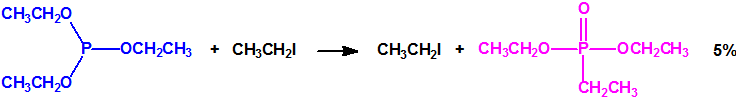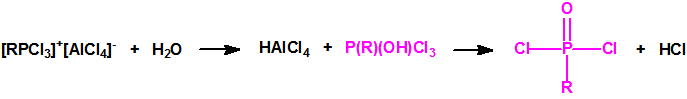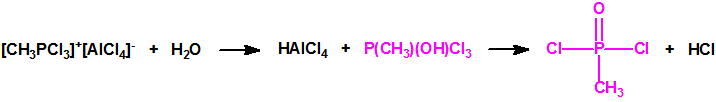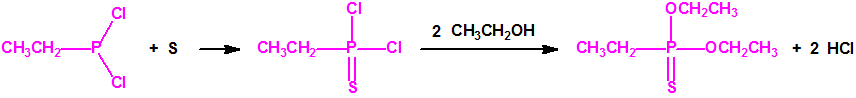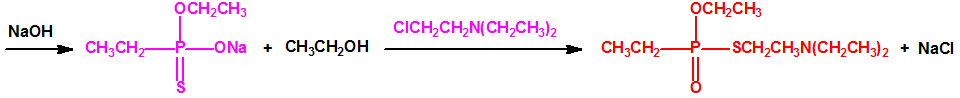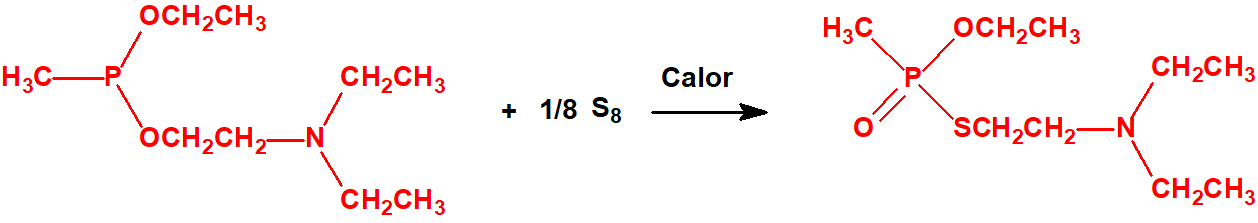La Lista 1
La Lista 1 del anexo de verificación de la Convención sobre las Armas Químicas (CAQ) incluía, a la entrada en vigor de la misma el 29 de abril de 1997, seis familias de agentes químicos de guerra, dos toxinas consideradas como agentes químicos (saxitoxina y ricina), dos familias de precursores y dos precursores individuales (cloro sarín y cloro somán)1, a saber:
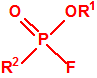
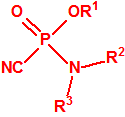
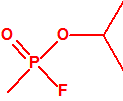
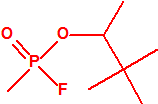
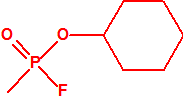
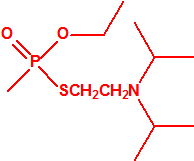
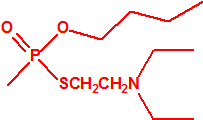
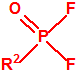
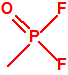
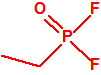
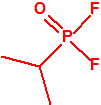
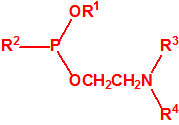
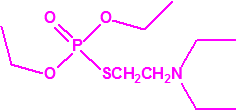
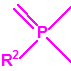
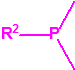
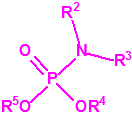
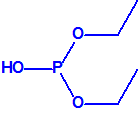
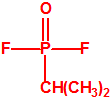
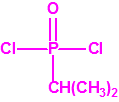
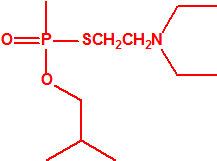
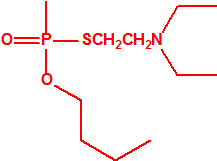
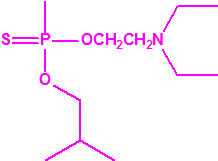
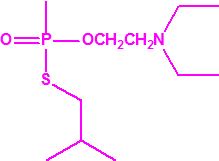
| 1A.1 | Alquilfosfonofluoridatos de O-alquilo (agentes neurotóxicos) (más de 20 000 sustancias) |
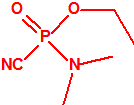
| 1A.2 | N,N-dialquilfosforamidatos de O-alquilo (agentes neurotóxicos) (más de 50 000 sustancias) |
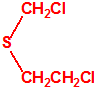
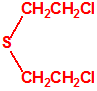
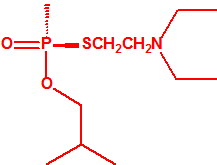
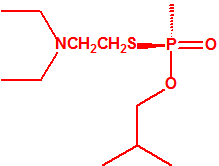
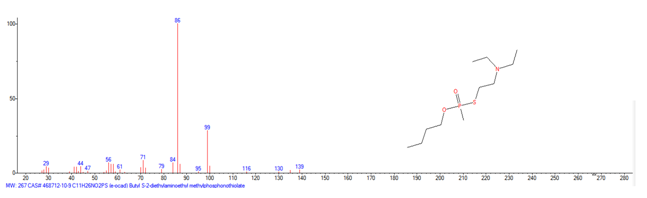
| 1A.3 | Alquilfosfonotiolatos de O-alquilo y S-2-dialquilaminoetilo (agentes neurotóxicos) (más de 200 000 sustancias) |
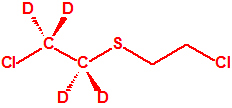
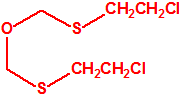
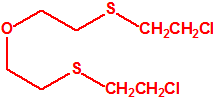
| 1A.4 | Mostazas de azufre (agentes vesicantes) (9 sustancias) |
| 1A.5 | Lewisitas (agentes vesicantes) (3 sustancias) |
| 1A.6 | Mostazas de nitrógeno (agentes vesicantes) (3 sustancias) |
| 1A.7 | Saxitoxina (1 sustancia) |
| 1A.8 | Ricina (1 sustancia) |
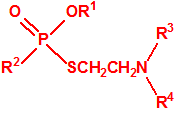
| 1B.9 | Fosfonildifluoruros de alquilo (4 sustancias) |
| 1B.10 | Alquilfosfonitos de O-alquilo y O-2-dialquilaminoetilo (más de 200 000 sustancias) |
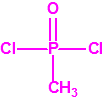
| 1B.11 | Cloro sarín (1 sustancia) |
| 1B.12 | Cloro somán (1 sustancia) |
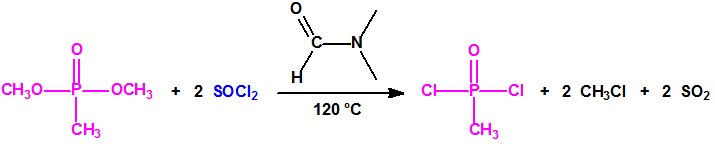
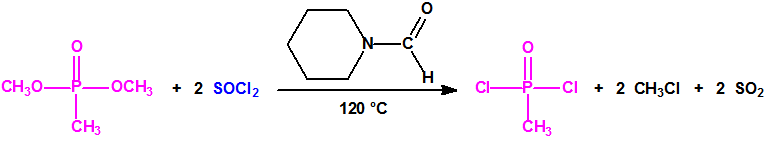
Es decir la Lista 1 contenía más de 470 023 sustancias de las cuales solo unos cientos tienen recogidos sus espectros en la Base de Datos Analítica de la Organización para la Prohibición de las Armas Químicas (OPAQ)2.
El embarazoso tema de la modificación del anexo
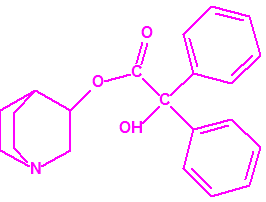
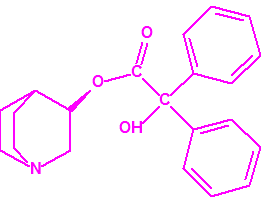
En Salisbury3,4, el 4 de marzo de 2018, el disidente soviético Sergei Skripal, su hija Yulia Skripal y el oficial de policía Nicholas Bailey resultaron intoxicados con una sustancia química tóxica, identificada por los laboratorios de Reino Unido, y por los laboratorios designados de la OPAQ, como una sustancia neurotóxica de la familia de los agentes «novichok». La estructura química de dicho agente «novichok» no se ha hecho pública hasta el momento, pero si se ha hecho público que era una sustancia de gran pureza (pese a lo cual, ninguno de los tres afectados llegó a fallecer). En abril de ese mismo año, Reino Unido acusó a Rusia ante la OPAQ del envenenamiento. Más tarde, el 30 de junio de 2018, en Amesbury3,5, el Sr. Charles Rowley y la Sra. Dawn Sturgess resultaron intoxicados con la misma sustancia neurotóxica que la identificada en el incidente de Salisbury, y la Sra. Sturgess falleció a causa de dicha intoxicación.
Tras estos hechos, el 16 de octubre de 2018, las Representaciones Permanentes ante la OPAQ del Canadá, los Estados Unidos de América y los Países Bajos presentaron la «Propuesta conjunta relativa a una modificación técnica de la Lista 1 del Anexo sobre sustancias químicas de la Convención sobre las Armas Químicas», de conformidad con los párrafos 1, 4 y 5 del artículo XV de la Convención (S/1682/2018, de fecha 25 de octubre de 2018)6. La propuesta conjunta propone la inclusión en la Lista 1 de dos nuevas familias de agentes neurotóxicos7:
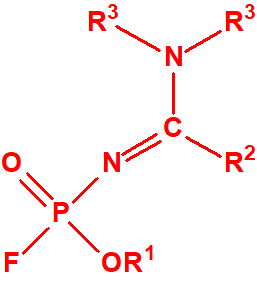
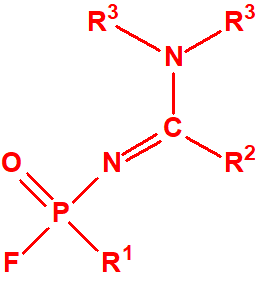
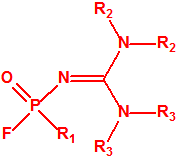
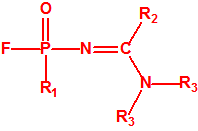
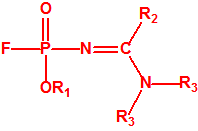
- Fluoruros fosforamídicos de P-alquilo (H o ≤ C10, incluido el cicloalquilo) N-(1-(dialquil (≤ C10, incluido el cicloalquilo)amino))alquilideno (H o ≤ C10, incluido el cicloalquilo) y sales alquilatadas o protonadas correspondientes (varios millones de sustancias).
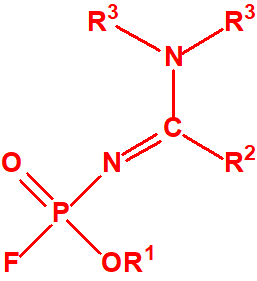
- Fosforamidofluoridatos de O-alquilo (H o ≤ C10, incluido el cicloalquilo) N-(1-(dialquil (≤ C10, incluido el cicloalquilo)amino))alquilideno (H o ≤ C10, incluido el cicloalquilo) y sales alquilatadas o protonadas correspondientes (varios millones de sustancias).
El 30 de noviembre de 2018, la Representación Permanente de la Federación de Rusia ante la OPAQ presentó las «Propuestas para introducir adiciones en las listas de sustancias químicas del Anexo sobre sustancias químicas de la Convención sobre las Armas Químicas», de conformidad con los párrafos 1, 4 y 5 del artículo XV de la Convención (S/1696/2018, de fecha 7 de diciembre de 2018)6. Aunque la OPAQ no ha hecho pública las Propuestas rusas, tal y como hizo con la Propuesta Conjunta, éstas han sido reveladas por la Oficina de Industria y Seguridad del Departamento de Comercio de Estados Unidos, como resultado de sus actividades para recopilar información que permita evaluar el impacto en la industria de Estados Unidos de las Propuestas Rusas de modificación del Anexo sobre productos químicos de la CAQ8.
Las propuestas rusas suponen la inclusión en la Lista 1 de cinco nuevas familias de agentes neurotóxicos8:
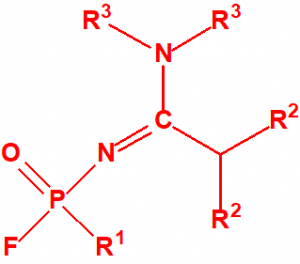
- Fluoruros de P-alquilo (H o ≤ C10, incluidos cicloalquilos) N-(1-(dialquil (≤ C10, incluidos cicloalquilos)amino))alquiliden (H o ≤ C10, incluidos cicloalquilos) fosforamídicos y sales alquilatadas o protonadas correspondientes (varios millones de sustancias).
- O-alquil (H o ≤ C10, incluidos cicloalquilos) N-(1-(dialquil (≤ C10, incluidos cicloalquilos)amino))alquiliden (H o ≤ C10, incluidos cicloalquilos) fosforamidofluoridatos y sales alquilatadas o protonadas correspondientes (varios millones de sustancias).
- P-alquil (H o ≤ C10, incluidos cicloalquilos)-(bis((alquil (H or ≤ C10, incluidos cicloalquilos)alquil (H or ≤ C10, incluidos cicloalquilos)amino))metilen) fosfonamidofluoridates y sales alquilatadas o protonadas correspondientes (varios millones de sustancias).
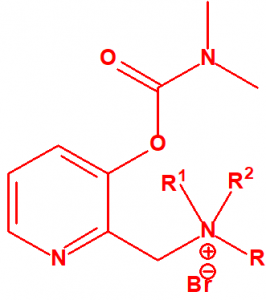
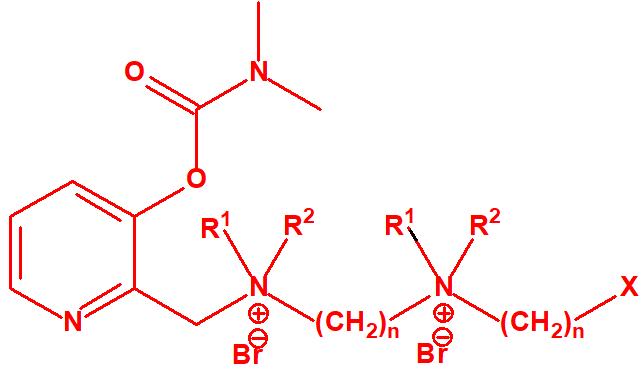
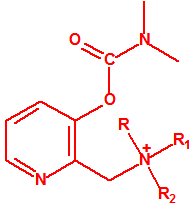
- Dimetil-carbamoiloxipiridinas cuaternarias (más de 1000 000 sustancias):
- 1-[N,N-dialquil(С≤10)-N-(n-(hidroxil, ciano, acetoxi)alquil(С≤10))amonio]-n-[N-(3-metil-carbamoxi-α-picolinil)-N,N-dialquil(С≤10)amonio]decano dibromuro (n=1-8)
- 1,n-bis[N-(3-dimetilcarbamoxi-α-picolil)-N,N-dialquil((С≤10)amonio]-alcano-(2,(n-1)-diona) dibromuro (n=2-12)
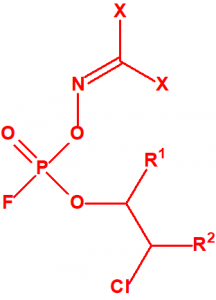
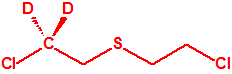
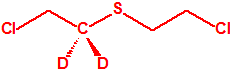
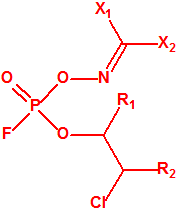
- O-(1-alquil (H, Me) 2-alquil (H,Me) -2-cloroetil)-(((dihalo(F, Cl)metilen)amino)-oxi)fosforofluoridatos (12 sustancias).
En la sexagésima segunda reunión del Consejo Ejecutivo, éste estudió y adoptó, por consenso, la decisión titulada «Recomendación relativa a una modificación de la Lista 1 del Anexo sobre sustancias químicas de la Convención sobre las Armas Químicas»7, (EC-M-62/DEC.1, de fecha 14 de enero de 2019, en la que recomendó a todos los Estados Partes la adopción de la Propuesta Conjunta (La Federación Rusa se desvinculó del consenso9) 6.
Unos días más tarde, en la sexagésima tercera reunión del Consejo Ejecutivo, el Consejo examinó las Propuestas de la Federación Rusa, y no adoptó el proyecto de decisión en el que se recomendaba su adopción (EC-M-63/DEC/CRP.1, de fecha 19 de febrero de 2019). Sobre esta base, se consideró que el Consejo recomendaba que se rechazaran las Propuestas de la Federación Rusa6.
Antes de que expirase el periodo de 90 días, el 14 de abril de 2019, para formular objeciones a la decisión del Consejo Ejecutivo de aprobar la Propuesta Conjunta, el 14 de abril de 2019, la Secretaría recibió una objeción de un Estado Parte (Federación Rusa) a la recomendación del Consejo de que se adoptara la Propuesta conjunta (EC-M-62/NAT.5, de fecha 9 de abril de 2019)6. Conforme a lo indicado al apartado e) del párrafo 5 del artículo XV de la Convención, al recibirse una objeción a la recomendación del Consejo, debía ser la vigésimo cuarta Conferencia de Estados Parte la que debía adoptar una decisión, como cuestión de fondo, sobre la Propuesta Conjunta de modificación de la Lista 1 del Anexo sobre sustancias químicas de la CAQ1.
Como era de esperar, días más tarde y antes de que expirase, el 27 de mayo de 2019, el periodo de 90 días para formular objeciones, la Secretaría recibió una objeción de un Estado Parte (República de Burundi) a la recomendación del Consejo de rechazar las Propuestas de la Federación de Rusia (EC-M-63/NAT.4, de fecha 9 de abril de 2019)6. Como ya se ha indicado, conforme a lo indicado al apartado e) del párrafo 5 del artículo XV de la Convención, al recibirse una objeción a la recomendación del Consejo, debía ser la vigésimo cuarta Conferencia de Estados Parte la que debía adoptar una decisión, como cuestión de fondo, sobre las Propuestas rusas de modificación de la Lista 1 del Anexo sobre sustancias químicas de la CAQ1.
Tras las consultas celebradas entre la Federación de Rusia, los Estados Unidos de América, el Canadá y los Países Bajos, con la participación de la Secretaría (S/1758/2019, de fecha 3 de junio de 2019; S/1785/2019, de fecha 16 de agosto de 2019; y S/1789/2019, de fecha 26 de agosto de 2019), la Federación de Rusia presentó al Director General una «Propuesta modificada para introducir modificaciones en la Lista 1 del Anexo sobre sustancias químicas de la Convención sobre las Armas Químicas» (S/1796/2019, de fecha 24 de septiembre de 2019)6,10.
Así llegamos a este punto donde todo parece indicar que la embarazosa situación de la modificación de la Lista 1 del Anexo sobre sustancias químicas de la CAQ se resolverá cuando la Conferencia de Estados Parte examine y apruebe tanto el proyecto de decisión sobre la Propuesta conjunta (C-24/DEC/CRP.1, de fecha 20 de septiembre de 2019), como la Propuesta modificada de la Federación de Rusia (C-24/DEC/CRP.5, de fecha 1 de noviembre de 2019).
Y parió la abuela
El 27 de noviembre de 2019, durante la vigésimo cuarta conferencia, la Conferencia de Estados Partes daba a luz a dos mellizos, la modificación del anexo conforme a la Propuesta Conjunta de los Estados Unidos de América, el Canadá y los Países Bajos, de fecha 16 de octubre de 2018, y la modificación del anexo conforme a las Propuestas Rusas, de fecha 24 de septiembre de 20197,11.
La Propuesta Conjunta consiste como ya se ha indicado en dos grandes familias de agentes neurotóxicos:
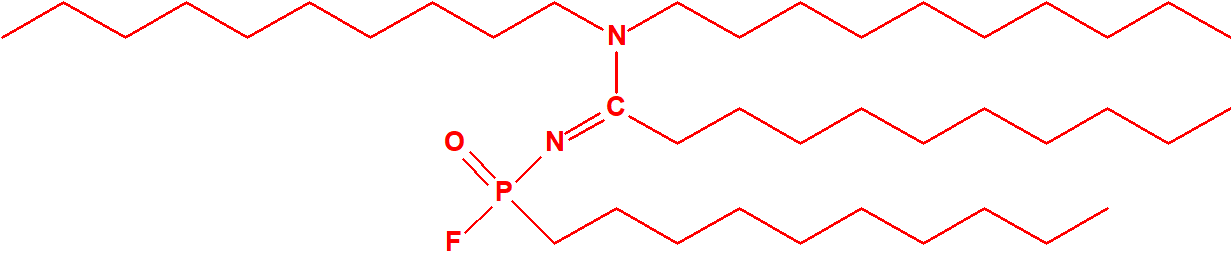
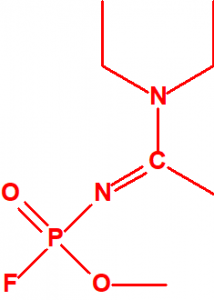
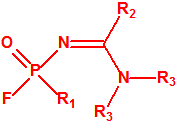
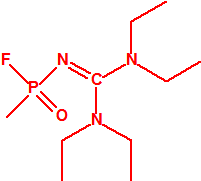
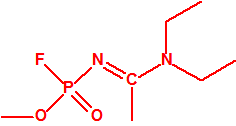
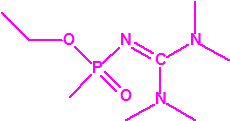
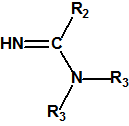
- Fluoruros de P-alquil (H o ≤ C10, incluidos cicloalquilos) N-(1-(dialquil (≤ C10, incluidos cicloalquilos)amino))alquiliden (H o ≤ C10, incluidos cicloalquilos) fosforamídicos y sales alquilatadas o protonadas correspondientes.
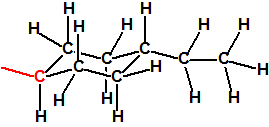
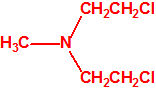
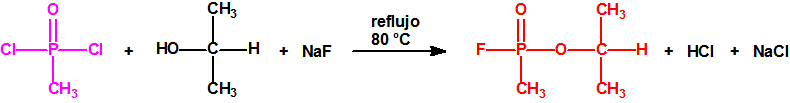
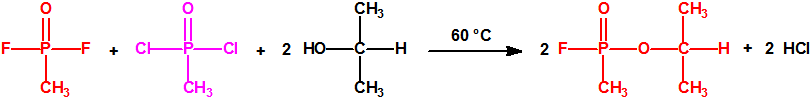
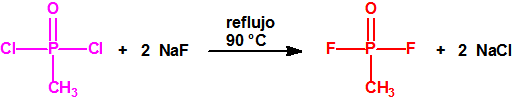
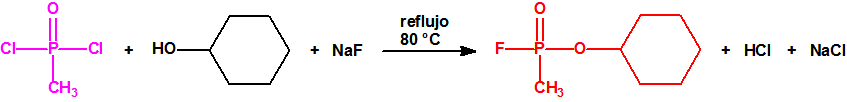
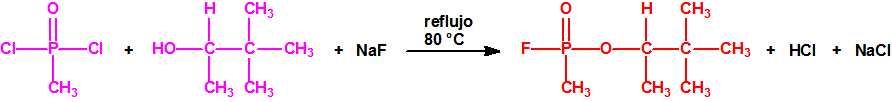
Ejemplo: fluoruro de N-(1-(di-n-decilamino)-n-deciliden)-P-decilfosfonamídico (sin número CAS).
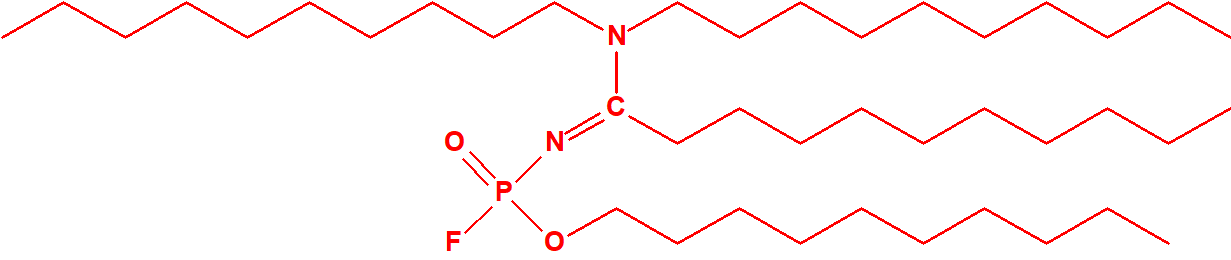
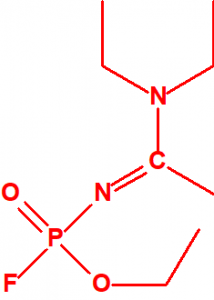
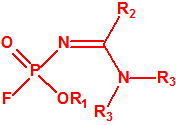
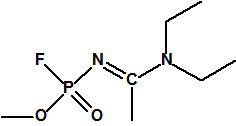
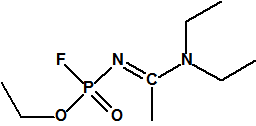
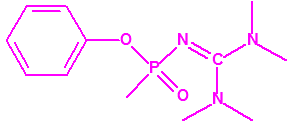
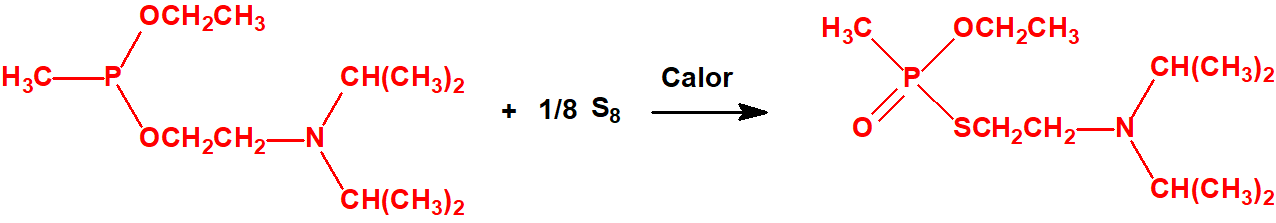
- O-alquil (H o ≤ C10, incluidos cicloalquilos) N-(1-(dialquil (≤ C10, incluidos cicloalquilos)amino))alquiliden (H o ≤ C10, incluidos cicloalquilos) fosforamidofluoridatos y sales alquilatadas o protonadas correspondientes.
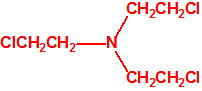
Ejemplo: O-n-decil N-(1-(di-n-decilamino)-n-deciliden) fosforamidofluoridato (sin número CAS).
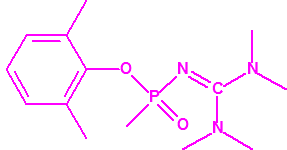
La Propuesta Rusa no se corresponde exactamente con la hecha pública por la Oficina de Industria y Seguridad del Departamento de Comercio de Estados Unidos. De las cinco familias indicadas en un primer momento se ha eliminado la última, correspondiente a los O-(1-alquil (H, Me)2-alquil (H,Me)-2-cloroetil)-(((dihalo(F, Cl)metileno)amino)-oxi)fosforofluoridatos. Además con excepción de la familia de los carbamatos las otras tres familias han reducido sustancialmente su tamaño10:
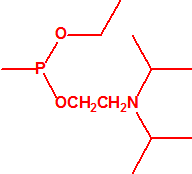
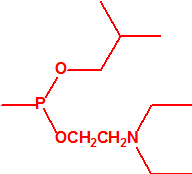
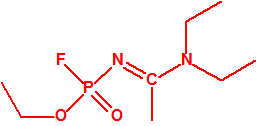
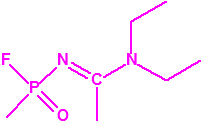
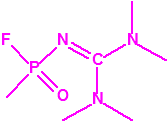
- O-alquil (Ме, Еt)-(1-(alquil (Me, Et)alquil (Me, Et)amino)etiliden) fosforamidofluoridatos:
Ejemplos:
Metil-(1-(dietilamino)etiliden)fosforamidofluoridato (sin número CAS)
Etil-(1-(dietilamino)etiliden)fosforamidofluoridato (sin número CAS)
Esta familia está incluida en la Propuesta Conjunta
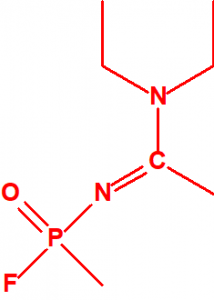
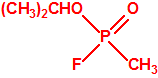
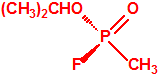
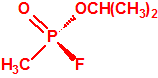
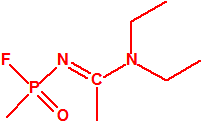
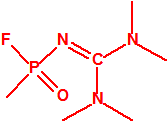
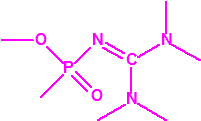
- Metil-(1-(dietilamino)etiliden)fosfonamidofluoridato (sin número CAS)
Esta sustancia está incluida en la Propuesta Conjunta
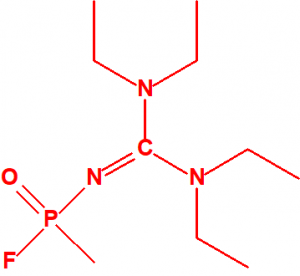
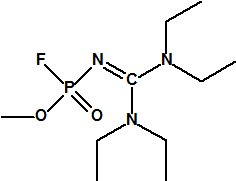
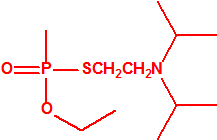
- Metil-(bis(dietilamino)metilen)fosfonamidofluoridato (sin número CAS)
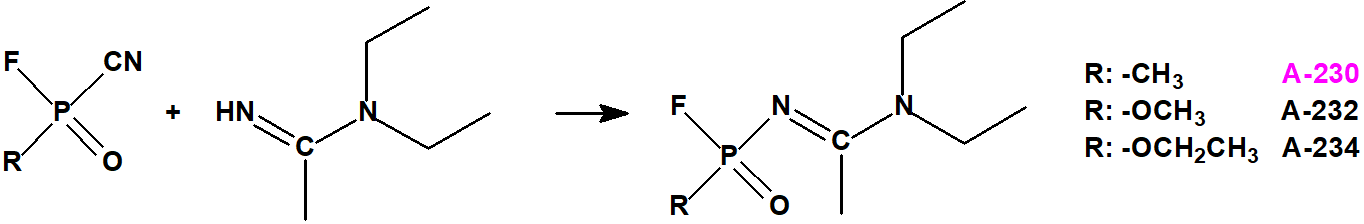
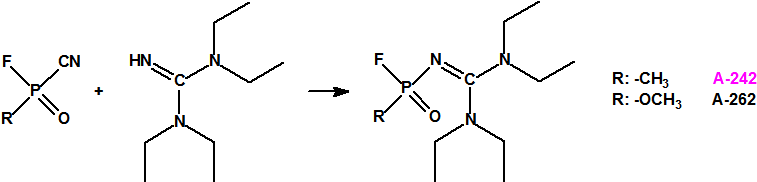
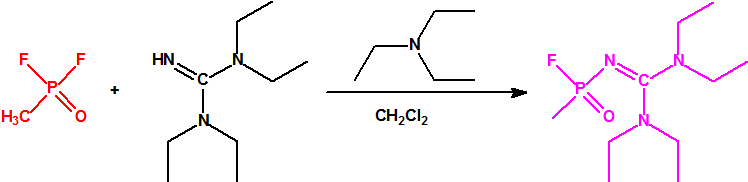
Esta sustancia no está recogida en la Propuesta Conjunta, y se correspondería con el agente A-242 descrito por Mirzayanov.
- Carbamatos (cuaternarios y bicuaternarios de dimetilcarbamoiloxipiridinas)
4.1 Cuaternarios de dimetilcarbamoiloxipiridinas:
Dibromuro de 1-[N,N-dialquil (С≤10) -N-(n-(hidroxil, ciano, acetoxi)alquil (С≤10)) amonio]-n-[N-(3-dimetil-carbamoxi-α-picolinil)-N,N-dialquil (С≤10)amonio]decano (n=1-8)
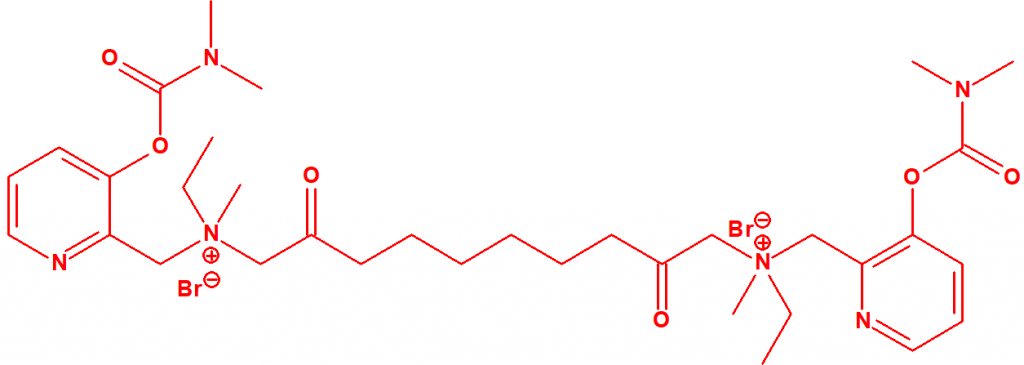
Ejemplo: Dibromuro de 1-[N,N-dimetil-N-(2-hidroxi)etilamonio]-10-[N-(3-dimetil carbamoxi-α-picolinil)-N,N-dimetilamonio]decano (CAS 77104-62-2)12.
4.2 Bicuaternarios de dimetilcarbamoiloxipiridinas:
Dibromuro de 1,n-bis[N-(3-dimetilcarbamoxi-α-picolil)-N,N-dialquil( (С≤10) amonio]- alcano-(2,(n-1)-diona) (n=2-12)
Ejemplo: Dibromuro de 1,10-bis[N-(3-dimetilcarbamoxi-α-picolil)-N-etil-N-metilamonio]- decano-2,9-diona (CAS 77104-00-8)12.
Conclusiones
- Está claro, no solo por el contenido de la Propuesta Conjunta, sino también por los considerandos que incluyen muchos documentos, y por las declaraciones realizadas por los Estados Unidos y Canadá en la Cuarta Conferencia de Revisión de la CAQ en noviembre de 2018, que dicha Propuesta Conjunta fue presentada para asegurar que todos los agentes «novichok», incluido el que se utilizó en los incidentes de Salisbury y Amesbury, fueran incluidos como agentes químicos de guerra en las Listas de la CAQ13. Se incluyen dos familias con millones de sustancias químicas por no hacerse pública la naturaleza de la sustancia tóxica utilizada en los incidentes citados. La idea que subyace en el fondo de la Propuesta Conjunta es acusar a la Federación Rusa de incumplir la CAQ. Sin embargo recordemos que los espectros de masas hechos públicos correspondientes al A-230 y al A-234 son aportaciones del centro militar estadounidense CBDCOM/ERDEC (Chemical Biological Defense Command/ Edgewood Research, Development and Engineering Center)14 a la librería de espectros de masas del NIST98.
- Parece también que la Propuesta Rusa busca acusar a Estados Unidos al incluir una numerosa familia de carbamatos de gran toxicidad patentados por el Ejército de Estados Unidos a finales de la década de 196013.
- Probablemente muchas de las sustancias incluidas ahora en la Lista 1 carecen de interés como agentes químicos de guerra, debido a que por su estructura y elevado peso molecular, son sólidos a temperatura ambiente y difícilmente utilizables por vía inhalatoria13.
- Ninguna de las propuestas incluye a los precursores necesarios que deberían ser incluidos en Lista 1 o en Lista 2, dependiendo de su posible uso no prohibido por la CAQ13,14.
- Debido a la falta de transparencia acerca de la estructura del «novichok» empleado en Salisbury y Amesbury, el número de sustancias químicas en la Lista 1 del Anexo sobre sustancias químicas ha aumentado exageradamente.
Referencias
- «Convención sobre la Prohibición del Desarrollo, la Producción, el Almacenamiento y el Empleo de Armas Químicas y sobre su Destrucción (CAQ)», disponible en https://www.opcw.org/fileadmin/OPCW/CWC/CWC_es.pdf y en https://www.opcw.org/fileadmin/OPCW/CWC/CWC_es.doc
- «Sampling and analysis in the CWC and the OPCW mobile laboratory» en «Chemical Weapons Convention chemicals analysis-Sample Collection, Preparation and Analytical Methods», Markku Mesilaakso, Wiley 2005.
- «Technical Assistance provided by OPCW related to toxic chemical incidents in Salisbury and Amesbury», https://www.opcw.org/media-centre/featured-topics/incident-salisbury
- «Note by the Technical Secretariat: Summary of the Report on Activities Carried Out in Support of a Request for Technical Assistance by the United Kingdom of Great Britain and Northern Ireland (Technical Assistance Visit TAV/02/18), s-1612-2018, https://www.opcw.org/sites/default/files/documents/S_series/2018/en/s-1612-2018_e___1_.pdf)
- «Note by the Technical Secretariat: Summary of the Report on Activities Carried Out in Support of a Request for Technical Assistance by the UK (Technical Assistance Visit TAV/03/18 and TAV/03B/18, «Amesbury Incident»)», s-1671-2018, https://www.opcw.org/sites/default/files/documents/2018/09/s-1671-2018%28e%29.pdf).
- «Annotated provisional agenda for the Twenty-Fourth Session of the Conference of the States Parties, 25 – 29 November 2019», C-24/INF.1/Rev.1, https://www.opcw.org/sites/default/files/documents/2019/11/c24inf01r1%28e%29.pdf)
- «Decision-Recommendation for a change to Schedule 1of the annex on chemicals to the Chemical Weapons Convention», EC-M-62/DEC.1 https://www.opcw.org/sites/default/files/documents/2019/01/ecm62dec01%2B%28e%29.pdf
- «Impact of Proposed Additions to the ‘Annex on Chemicals’ to the Chemical Weapons Convention (CWC) on Legitimate Commercial Chemical, Biotechnology, and Pharmaceutical Activities Involving ‘Schedule 1’ Chemicals (Including Schedule 1 Chemicals Produced as Intermediates),» Federal Register, Vol. 84, No. 157 (2019), <www.govinfo.gov/content/ pkg/FR-2019-08-14/pdf/2019-17256.pdf>
- «Report of the sixty-second meeting of the Executive Council», EC-M-62/2, https://www.opcw.org/sites/default/files/documents/2019/01/ecm6202%28e%29.pdf
- «Decision-Changes to Schedule 1 of the Annex on chemicals to the Chemical Weapons Convention», C-24/DEC.5, https://www.opcw.org/sites/default/files/documents/2019/11/c24dec05%28e%29.pdf
- «Technical change to Schedule 1(A) of the Annex on chemicals to the Chemical Weapons Convention», C-24/DEC.4, https://www.opcw.org/sites/default/files/documents/2019/11/c24dec04%28e%29.pdf
- Handbook of Chemical and Biological Warfare Agents-D. Hank Ellison 2Ed CRC Press 2008
- «Controlling Novichoks after Salisbury: revising the Chemical Weapons Convention schedules», Stefano Costanzi & Gregory D. Koblentz, The Nonproliferation Review, September 2019
- «Se les ve el plumero», J.Domingo, https://cbrn.es/?p=1403