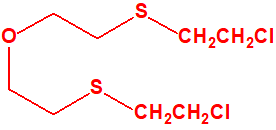
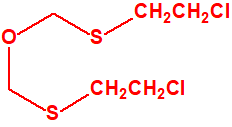
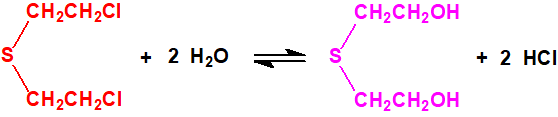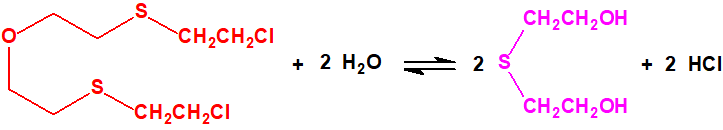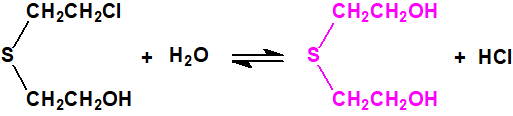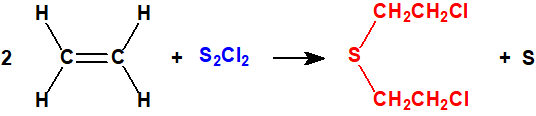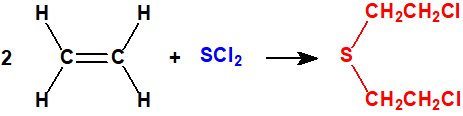El agente T es el bis(2-cloroetiltioetil)éter, de número CAS 63918-89-8. Es una sustancia vesicante recogida por la Convención para la Prohibición de las Armas Químicas (CAQ) en su lista 1A, como un agente químico de guerra de la familia 1A.4 Mostazas de azufre, con el número 1A.4.8. Al tratarse de un éter de la familia de las mostazas de azufre también se conoce como «mostaza O».1
|
Lista 1A.4.9 bis(2-cloroetiltioetil)éter, mostaza O, agente T, 1-(2-cloroetilsulfanil)-2-[2-(2-cloroetilsulfanil)etoxi]etano CAS 63918-89-8 |
La familia 1A.4 de las mostazas de azufre incluye, además del bis(2-cloroetiltioetil)éter o agente T (CAS 63918-89-8), otro éter, el bis(2-cloroetiltiometil)éter (CAS 63918-90-1)1:
|
Lista 1A.4.8 bis(2-cloroetiltiometil)éter CAS 63918-90-1 |
Sin embargo la Lista 1A.4 no incluye el bis(2-cloroetil)éter (CAS 111-44-4), el análogo oxigenado de la iperita, ni tampoco el sulfuro de 2-cloroetilo y etilo (CAS 693-07-2) utilizado como simulador de la iperita1:
Iperita, H, sulfuro de 2-cloroetilo CAS 505-60-2 |
bis(2-cloroetil)éter, BCEE CAS 111-44-4 |
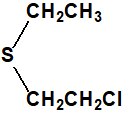
Sulfuro de 2-cloroetilo y etilo CAS 693-07-2 |
Preparación del agente T2
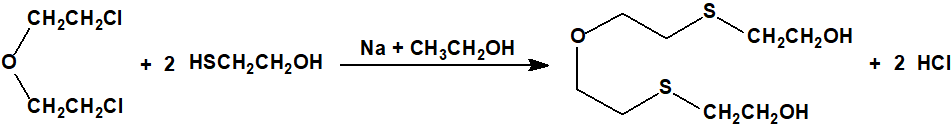
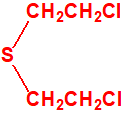
La conversión del tiodiglicol (CAS 111-48-8) en sulfuro de bis(2-cloroetilo) (CAS 505-60-2, iperita, gas mostaza, H) por medio del ácido clorhídrico concentrado en caliente fue realizada por primera vez por Hans Thacher Clarke3, superando así las dificultades asociadas con el uso de tricloruro de fósforo (CAS 7719-12-2) del método original de Victor Meyer4.
Desde entonces, el proceso ha sido objeto de muchas investigaciones, ya que fue el único método utilizado por los alemanes en la Primera Guerra Mundial para la fabricación de la iperita o gas mostaza. Davies y Oxford encontraron que a 100 °C la reacción producía una mezcla de sulfuro de bis(2-cloroetilo) y un aceite no destilable, que demostraron era bis(2-cloroetiltioetil)éter.5
En 1932 esta reacción fue estudiada con mayor detalle por el H.M. Research Establishment, y a pesar de que resultó imposible repetir en su totalidad todos los hallazgos de Davies y Oxford, quedó demostrado que el componente principal del aceite no destilable era el bis(2-cloroetiltioetil)éter, y también que éste tenía un poder vesicante de 325 en comparación con el estándar arbitrario de 100 establecido para la iperita o gas mostaza2.
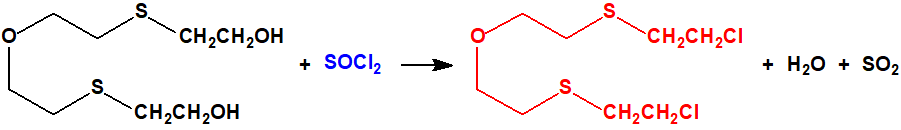
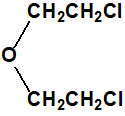
El bis(2-cloroetiltioetil)éter fue sintetizado F. N. Woodward mediante la acción del cloruro de tionilo (CAS 7719-09-7) en cloroformo o dimetilanilina sobre el bis(2-hidroxietiltioetil)éter (7426-02-0), obtenido a su vez a partir del bis(2-cloroetil)éter (CAS 111-44-4) y la sal sódica del 2-mercaptoetanol (CAS 60-24-2)2:
El bis(2-cloroetiltioetil)éter es un líquido incoloro con olor típico a mostaza, que destila a 174 °C (a 2 mmHg, con una descomposición considerable), y a 120 °C (a 0,001 mmHg, con una leve descomposición). A diferencia del bis(2-hidroxietiltioetil)éter no reacciona con los yoduros de alquilo, la cloramina-T, el cloruro o el yoduro de mercurio, el yodo o el bromo2.
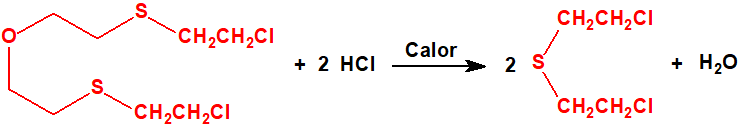
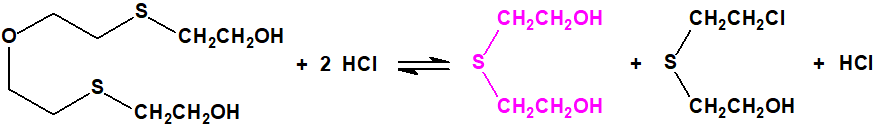
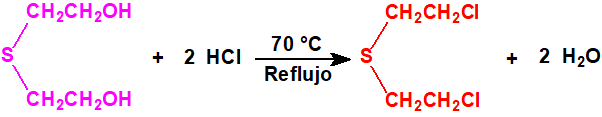
El bis(2-cloroetiltioetil)éter apenas resulta afectado por la acción del ácido clorhídrico concentrado a 100 °C, aunque con cloruro de hidrógeno a temperaturas elevadas tiene lugar su escisión parcial con formación de sulfuro de bis(2-cloroetilo) y agua2:
Propiedades del agente T6,7,8
El agente T o «mostaza O» (CAS 63918-89-8) es un líquido amarillo, que cuando es puro tiene poco o ningún olor, pero cuando no lo es tiene un olor similar al ajo o al rábano picante. De formula empírica C8H16Cl2OS2, tiene un peso molecular de 263,25, funde a 9,4 °C (49 °F), y se descompone antes de alcanzar su punto de ebullición. Su presión de vapor es bastante baja, 0,00003 mmHg a 25 °C (77 °F). Como líquido tiene una densidad de 1,236 g/mL a 25 °C (77 °F), y como vapor, una densidad relativa calculada de 9,1.
Con un ICt50 (piel) de 400 mg´min/m3 (1 ppm para una exposición de 30 minutos)9, la mostaza oxigenada es 3,5 veces más vesicante que la iperita (1 ppm = 10,77 mg/m3 a 25 °C).
El tiodiglicol y el cloruro de hidrógeno gaseoso a alta temperatura producen una mezcla 60:40 de iperita y un residuo que contiene agente T y homólogos relacionados. La mezcla HT resultante se emplea como tal para la carga de municiones9.
Hidrólisis y oxidación del agente T9,10
La degradación de la mostaza de azufre y sus análogos tiene lugar por hidrólisis y por oxidación. La hidrólisis tiene lugar a través de un ion episulfonio cíclico y da como resultado el reemplazo gradual de los átomos de cloro por grupos hidroxilo. La oxidación del azufre produce primero el sulfóxido y luego la sulfona. Estos son sustancias estables e importantes marcadores forenses9.
Tanto la iperita como el agente T se hidrolizan a tiodiglicol:
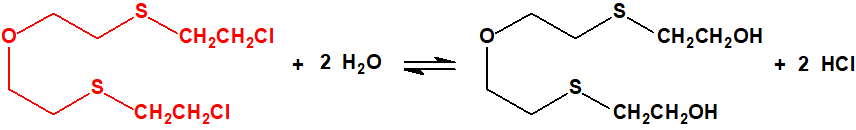
Parece que la hidrólisis del agente T tiene lugar en varias etapas:
El agente HT7,8
El agente HT es en realidad una mezcla constituida por un 60% en peso de iperita (H, HD) y un 40% en peso de bis(2-cloroetiltioetil) éter (agente T), que tiene asignado el número CAS 172672-28-5. Parece que con el paso del tiempo estas proporciones pueden variar, y que la presencia de impurezas podría dar lugar a diversos productos de reacción8.
La iperita, gas mostaza, o HD, tiene de fórmula empírica C4H8Cl2S (peso molecular 159,08) y el agente T tiene de fórmula empírica C8H16Cl2OS2 (peso molecular 263,25).
El agente HT corroe rápidamente el latón y, a 65 °C, corroe el acero a una velocidad de 0,001 pulgadas por mes. Se hidrolizará para formar HCl y tiodiglicol y éter bis-(2-(2-hidroxietiltio etílico.
La siguiente tabla compara las propiedades de la iperita (agente H), la mostaza «O» (agente T) y la mezcla denominada agente HT6,7,8
| Agente H | Agente T | Agente HT | |
| Nombre químico | Sulfuro de 2-cloroetilo | bis(2-cloroetiltioetil) éter | Generalmente una mezcla con un 60% de iperita o agente H (mostaza azufrada) y un 40% de agente T (mostaza oxigenada) |
| Fórmula química | C4H8Cl2S | C8H16Cl2OS2 | Mezcla |
| Peso molecular | 159,08 | 263,25 | 188,96 (en base a un 60/40 % en peso) |
| Líquido aceitoso, entre incoloro o ámbar y marrón oscuro. Sólido amarillo por debajo de 14,4 °C (58 °F). El material puro es inodoro pero si no es puro tiene un olor similar al ajo o al rábano picante que es detectable a aproximadamente 0,1 ppm. | Líquido amarillo. El material puro tiene poco o ningún olor; de lo contrario, tiene un olor similar al ajo o al rábano picante. | Líquido claro altamente viscoso de color amarillo a marrón. El material puro es inodoro; de lo contrario, tiene un olor similar al ajo o al rábano picante. El olor es menos pronunciado que el del agente H. | |
| Densidad | 1,27 g/mL a 25 °C (77 °F) | 1,236 g/mL a 25 °C (77 °F) | 1,269 g/mL a 25 °C (77 °F) |
| Punto de fusión | 14,4 °C (58 °F) | 9,4°C (49 °F) | 0°C (32 °F) |
| Densidad relativa a 20 °C | 5,5 (calculada) | 9,1 (calculada) | 6,5 (calculada) |
| Punto de ebullición | 218 °C (extrapolado)8 Descompone a 180 °C7 | 373,8 °C6 Descompone7 | 373,8 °C a 760 mmHg6 Descompone entre 165 °C y 180 °C8 |
| Presión de vapor | 0,11 mmHg a 25 °C (77 °F) | 0,00003 mmHg a 25 °C (77 °F) | 0,0000188 mmHg a 25 °C6
0,077 mmHg a 25 °C (77 °F) |
| Volatilidad, mg/m3 a 25 °C | 906 (calculada a partir de la presión de vapor)8 | 0,426 | 783 (calculada a partir de la presión de vapor)8 |
| Punto de inflamación | 105 °C (221 °F) | 179,9 °C | 100 °C (212 °F)6
109°C (228 °F)7 |
| Diffusion coefficient for vapor in air (cm2/sec) | 0,060 a 20 °C (a 68°F) | 0,05 a 25 °C (a 77°F) | |
| Punto de inflamación | 105 °C | De 109 °C a 115 °C | |
| Tensión superficial, dynes/cm | 43,2 a 20 °C (68 °F) | 42,01 a 25 °C (77 °F) | |
| Viscosidad, cSt | 3,52 a 20 °C (68 °F) | 6,05 a 20 °C (68 °F) | |
| Densidad del líquido, g/cm3 | 1,2685 a 25 °C | 1,24 a 25°C | 1,263 a 20 °C |
| Solubilidad | 0,092 g en 100 g de agua destilada a 22 °C (72 °F); soluble en acetona, tetracloruro de carbono, cloroformo, tetracloroetane, benzoate de etilo, éter dietílico | Insoluble en agua | Ligeramente soluble en agua; soluble en la mayoría de los disolventes orgánicos |
Preparación del agente HT11
Durante la Segunda Guerra Mundial se utilizaron varios métodos de fabricación para producir iperita (mostaza de azufre) con el fin de maximizar la producción con los equipos y las materias primas disponibles en ese momento:
- El método del monocloruro de azufre.
El etileno (CAS 74-85-1) y el monocloruro de azufre (CAS 10025-67-9) reaccionan para dar iperita y azufre. Esta fue la base de los procesos «Levinstein estadounidense» y DESA sudafricano (Defence Establishment South Africa). El proceso de monocloruro de azufre fue utilizado por Reino Unido durante la Primera Guerra Mundial y se desarrolló mejor en el periodo entre-guerras. Finalmente Reino Unido decidió que el proceso no era satisfactorio y éste quedó obsoleto.
| 1 | |
| 2 |  |
| 3 | 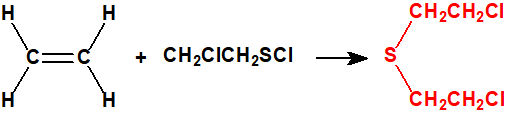 |
- El método «pyro» o del etileno-dicloruro de azufre.
Este era mucho más rápido que el proceso de monocloruro. Con el empleo de dicloruro de azufre (CAS 10545-99-0) no se formaba azufre, evitando así la principal complicación de la reacción con el monocloruro de azufre. El proceso fue capaz de producir iperita de buena calidad, pero se encontraron dificultades debido a las impurezas del dicloruro de azufre.
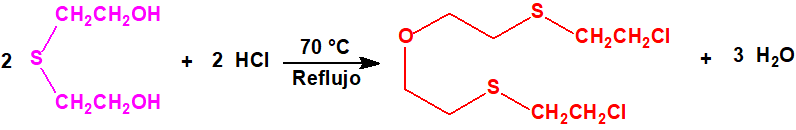
- El método del tiodiglicol.
El HT puede prepararse por reacción entre el tiodiglicol y el ácido clorhídrico. La mezcla de agente H y de agente T tenía las ventajas de ser estable durante su almacenamiento, y era de menor punto de congelación, y más vesicante y persistente que el agente H puro. Debido en gran parte a todas estas razones, el HT se convirtió en el agente vesicante británico favorito en la Segunda Guerra Mundial, y se produjo en grandes cantidades.
El HT también era conocido como Runcol dado que gran cantidad del mismo se produjo en la fábrica de Rocksavage en la localidad de Runcorn, en Cheshire, Reino Unido.
Como ya se ha indicado el HT es una mezcla de iperita, conocida como agente H, y agente T, también conocido como «mostaza O» o sustancia T.724, preparado mediante reacción del tiodiglicol (TDG) con el cloruro de hidrógeno, a unos 110 °C. La variación en las condiciones de reacción, de las cuales la temperatura es la más importante, da lugar a alguna variación en la composición del producto. El producto normal es una mezcla H/T 60/40 en peso, aunque la parte «T» suele contener cantidades apreciables de los homólogos del agente T y compuestos relacionados.
El cloruro de hidrógeno gaseoso se prepara a partir de ácido clorhídrico acuoso y ácido sulfúrico concentrado. El ácido gastado se concentra para recuperar el ácido sulfúrico. Se pasa cloruro de hidrógeno, bajo una ligera presión, sobre el tiodiglicol (TDG) precalentado mezclado con una proporción de ácido clorhídrico acuoso. Una vez completada la reacción, la mezcla se transfiere a un decantador. El producto se separa de la capa acuosa y se seca calentando a presión reducida.
La estabilidad de la presión. en contenedores de almacenamiento y municiones, del agente HT era mejor que la de cualquier otra producción obtenida a gran escala del agente H, y esta era su principal ventaja sobre otros métodos de producción. Además, dado que el agente T es aproximadamente 3 veces más vesicante que el agente H, el poder vesicante de la mezcla era mayor que el del agente H puro, y significativamente mayor que otras mezclas del agente H en uso en ese momento, que contenían diluyentes inertes para reducir el punto de congelación para su empleo en invierno o en zonas frías. El comportamiento a baja temperatura del agente HT era tal, que aunque su punto de fusión era de 1,8 °C, era «bastante fluido» a -10 °C y «una papilla suave» a -15°C.
Agente HT espesado11,12,13,14,15,16
Los británicos agregaron diferentes agentes espesantes tanto a la iperita o gas mostaza, como al agente HT, para mejorar sus características de dispersión, especialmente cuando se empleaba munición con explosión aérea.
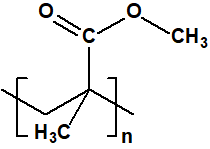
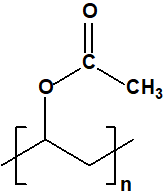
Los agentes más comunes utilizados para espesar las mostazas eran el caucho clorado, el «Plexiglás®» (metacrilato de polimetilo), y el acetato de vinilo o » Gelva®» (acetato de polivinilo de bajo peso molecular).
 |
 |
| metacrilato de polimetilo
poli(metil-2 metilpropenoato) CAS 9011-14-7 |
acetato de polivinilo
CAS 9003-20-7 |
Plexiglas® es una marca comercial de ELF Atochem, ahora una subsidiaria de Arkema una marca registrada de Evonik Röhm GmbH en otras partes del mundo. Hasta 1998 esta marca comercial pertenecía a la empresa química Rohm & Haas, quienes la registraron inicialmente, y comercializaron por primera vez el metacrilato.
Gelva® es una marca registrada de Solutia (adquirida en 2003 por el Grupo UCB) para una serie de polímeros de acetato de polivinilo disponibles como sólidos o emulsiones acuosas. Las resinas Gelva® se utilizan como adhesivos, aglutinantes, bases para chicles, revestimientos, adhesivos termofusibles, pinturas, revestimientos de papel, aprestos textiles y espesantes.
Hubo problemas para mantener constante la viscosidad del agente HT, durante su almacenamiento prolongado en contenedores de acero, incluso cuando éste estaba barnizado, cuando se espesaba con caucho clorado o con acetato de vinilo debido en gran parte a la presencia de pequeñas cantidades de cloruro ferroso, el cual promovería un aumento de la viscosidad que conduciría finalmente a la gelificación. Además, el contenido de hierro de agente HT que podía variar ampliamente (entre 50 ppm y 350 ppm en peso) tendería a aumentar por la acción de trazas de ácido clorhídrico sobre los recipientes de almacenamiento de acero a pesar del efecto protector del barniz que nunca podría ser del 100%. En un intento por minimizar la producción de cloruro ferroso, se probaron varios estabilizadores, incluido el óxido de magnesio, la hexamina y dimetilanilina.
Referencias
- «Convención sobre la Prohibición del Desarrollo, la Producción, el Almacenamiento y el Empleo de Armas Químicas y sobre su Destrucción», Organización para la Prohibición de las Armas Químicas (OPAQ), https://www.opcw.org/sites/default/files/documents/CWC/CWC_es.pdf
- «New Organic Sulphur Vesicants. Part I. 2,2′-Di-(2-chloroethylthio)diethyl Ether», F. N. Woodward, Journal of the Chemical Society, 1948, 35-38.
- «CLXX. 4-Alkyl-1:4-thiazans», Hans Thacher Clarke, Journal of the Chemical Society, Transactions, 1912, vol. 101, p. 1583-1590
- «Ueber Thiodiglykolverbindungen», Victor Meyer, Berichte der deutschen chemischen Gesellschaft, 1886, vol. 19, no 2, p. 3259-3266
- «XXX. – Formation of sulphonium chlorides and of unsaturated substances by the action of water and of aqueous alcoholic potash on ββ′-dichlorodiethyl sulphide», J. S. H. Davies & A. E. Oxford, Journal of the Chemical Society (Resumed), 1931, p. 224-236
- «Compendium of Chemical Warfare Agents», Steven L. Hoenig, Springer, 2007
- «Handbook of Chemical and Biological Warfare Agents», Hank Ellison, 2nd, CRC Press, 2008
- «Review of Secondary Waste Disposal Planning for the Blue Grass and Pueblo Chemical Agent Destruction Pilot Plants», National Research Council, The National Academies Press, Washington, DC, 2008
- «Hydrolysis and oxidation products of the CWAs 1,2-bis[(2-chloroethyl)thio]ethane Q and 2,2-bis(2-chloroethylthio)diethyl ether T», Christopher M. Timperley, Robin M. Black, Michael Bird, Ian Holden, Joanna L. Mundy, and Robert W. Read, Phosphorus, Sulfur, and Silicon, 178:2027–2046, 2003.
- «Hydrolysis and Biodegradation of the Vesicant Agent HT: Two Potential Approaches», Steven P. Harvey, Linda L. Szafraniec and William T. Beaudry, Bioremediation Journal 2(3&4):191-203 (1998)
- ADA474050, «Review of World War 2 Methods of Manufacture and Storage for UK Sulphur Mustard (HT) Currently Held at Pine Bluff Arsenal, Arkansas, USA», Richard Soilleux, Dstl Porton Down, 2007.
- «Polimetilmetacrilato», https://es.wikipedia.org/wiki/Polimetilmetacrilato.
- «Acetato de polivinilo», https://es.wikipedia.org/wiki/Acetato_de_polivinilo
- «Gelva», https://cameo.mfa.org/wiki/Gelva
- «The stability of polyvinyl acetate in technical mustard gas solution», J. Idris Jones, Chem. Soc., 1952, 883-892
- «The viscosity instability of solutions of high polymers», James Murray Holmes, Thesis, 1944, https://escholarship.mcgill.ca/downloads/vm40xw22k?locale=en