El cianuro de hidrógeno también conocido como ácido cianhídrico, ácido prúsico, metanonitrilo o formonitrilo fue descubierto en el año 1783 por el químico sueco Carl Wilhelm Scheele. Su fórmula química es HCN y su número CAS es el 74-90-8. Al ser una molécula pequeña (de peso molecular 27,03) tiene un bajo punto de fusión (- 13°C) y un bajo punto de ebullición (26°C). También por ello sus vapores tienen una densidad relativa inferior a la del aire (0,98), de modo que al ser menos densos ascienden y se disipan con facilidad, sobre todo en campo abierto. Los vapores de cianuro de hidrógeno tienen un olor característico a almendras amargas y se disuelven fácilmente en el agua, acidulando la misma por formación de ácido cianhídrico (pKa=9,25).
El cianuro de hidrógeno fue utilizado durante la Primera Guerra Mundial como agente químico de guerra, con escaso éxito, pues debido a su volatilidad y baja densidad de sus vapores, éstos se disipan con facilidad, y dificultan la consecución de concentraciones altas, suficientemente letales. Los franceses entusiastas del empleo del cianuro de mezclaban éste con otras sustancias para conseguir una mezcla de vapores más densa, que pudiera ser inhalada, para conseguir efectos letales, pero también con escaso éxito. En cambio los alemanes, durante la Segunda Guerra Mundial sí que emplearon el cianuro de hidrógeno en las cámaras de gas de los campos de concentración, con un producto denominado Zyklon B.
El cianuro de hidrógeno, los halogenuros de ciánogeno y las sales y complejos de cianuro son considerados «agentes cianogénicos», que interfieren la utilización del oxígeno a nivel celular, siendo en muchos casos erróneamente denominados «agentes sanguíneos». El cianuro de hidrógeno irrita los ojos y el tracto respiratorio, pudiendo producir efectos nocivos en la respiración celular que conllevan a convulsiones, pérdida del conocimiento e incluso a la muerte.
A pesar de su escaso empleo como agente químico de guerra, el cianuro de hidrógeno y las sales de cianuro tienen numerosas y muy variadas aplicaciones industriales (se utiliza para la producción de acrilonitrilo, acrilatos y metacrilatos, cianuros inorgánicos, adiponitrilo, hexametilendiamina, metionina, etc.). De hecho, el cianuro de hidrógeno está recogido por la CAQ como agente químico de Lista 3, al igual que el cloruro de cianógeno (ClCN, CAS 506-77-4). La CAQ no incluye en sus listas ninguna sal del ácido cianhídrico, pero el cianuro sódico (NaCN, CAS 143-33-9) y el cianuro potásico (KCN, CAS 151-50-8) si están recogidos en la lista de control de las exportaciones del Grupo de Australia, como precursores de armas químicas.
Recordemos que la Lista 3 incluye sustancias químicas tóxicas y precursores no incluidos en las Listas 1 y 2:
- que se han producido, almacenado o empleado como armas químicas,
- se producen en grandes cantidades comerciales para fines no prohibidos y
- suponen un riesgo para el objeto y propósito de la CAQ debido a que poseen tal toxicidad letal o incapacitante y otras propiedades que podrían permitir su empleo como arma química y emplearse en la síntesis de sustancias químicas de la Lista 1 o de la Lista 2.
La CAQ establece declaraciones y inspecciones sobre las instalaciones industriales que producen, procesan o consumen ciertas sustancias químicas de doble uso por encima de unos determinados valores umbrales. En el caso del cianuro de hidrógeno, Lista 3, el valor umbral de declaración está establecido en 30 tm y el umbral de verificación en 200 tm. La capacidad promedio de las instalaciones industriales productoras de cianuro de hidrógeno (DuPont, Rohm y Haas, Novartis, Cyanco, ICI, Butachemie, Röhm y Elf-Atochem, entre otras) está entre las 5000 y las 30000 toneladas/año.
A pesar de todo lo expuesto el cianuro de hidrógeno no suele almacenarse, lo que posibilitaría su empleo como agente químico de guerra, sino que suele obtenerse «in situ» para un uso inmediatamente posterior, por ejemplo para la síntesis de la metionina, un aminoácido esencial empleado habitualmente en la composición de los piensos compuestos. Es decir, el HCN se utiliza para engordar.
Producción del HCN
A escala industrial el método más utilizado para obtener cianuro de hidrógeno es el método de Andrussow, y en menor medida, el método de BMA-Degussa y el método de Shawinigan.
Método de Andrussow
El método está basado en una reacción descubierta en 1927 por Leonid Andrussow, un ingeniero químico letón (soviético), que trabajaba para la IG Farben (BASF). Andrussow, desarrolló en años posteriores el proceso industrial que lleva su nombre, y lo patentó en 1931.
La reacción de Andrussow consiste en la oxidación del metano y del amoniaco en presencia de oxígeno y de un catalizador de platino, una reacción fuertemente exotérmica que produce cianuro de hidrógeno:
CH4 + NH3 + 1.5 O2 → HCN + 3 H2O
El cambio de entalpía para esta reacción es ΔH = -474 kJ/mol.
El calor proporcionado por esta reacción actúa como catalizador para diversas reacciones secundarias:
CH4 + H2O → CO + 3 H2
2 CH4 + 3 O2 → 2 CO + 4 H2O
4 NH3 + 3 O2 → 2 N2 + 6 H2O
Para reducir en lo posible estas reacciones secundarias hay que reducir enormemente el tiempo de contacto de las materias primas con el catalizador; los tiempos de contacto son del orden de 0,0003 segundos.
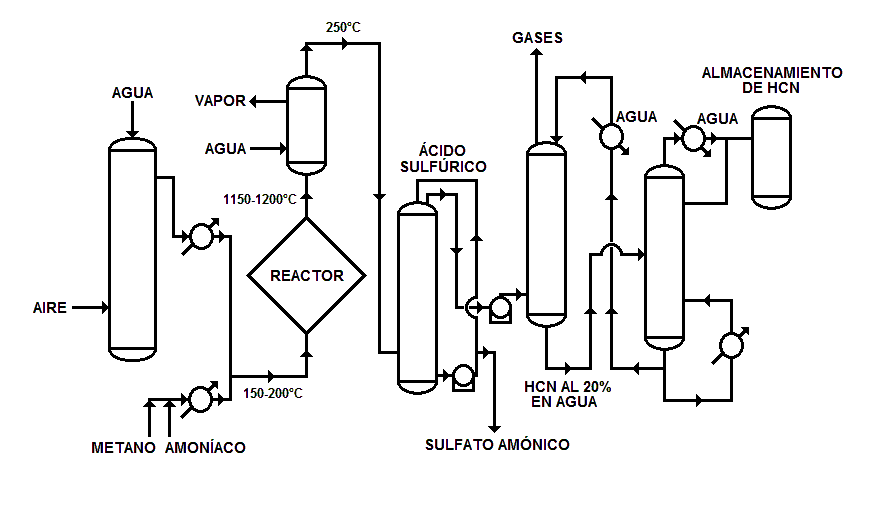
Como muestra el diagrama, el gas natural, esencialmente metano libre de azufre, se mezcla con amoníaco y se añade aire comprimido en una proporción muy cercana a la que corresponde a la reacción teórica.
La mezcla se lleva al reactor, donde se pasa sobre una malla de platino-rodio o platino-iridio que actúa como catalizador, mientras se vigila y controla cuidadosamente la temperatura y el límite superior de inflamabilidad. La reacción tiene lugar a más de 1000 °C y a presión atmosférica, con una velocidad de paso de la mezcla gaseosa de 3 m/s en la zona del catalizador. Para evitar la descomposición de HCN, el efluente gaseoso del reactor se enfría rápidamente y el vapor de agua producido en el intercambiador de calor se emplea en otras fases del proceso.
El efluente gaseoso enfriado se lava con ácido sulfúrico diluido para eliminar el amoníaco que no ha reaccionado y evitar así la polimerización del HCN. Puesto que la solución de sulfato de amonio es un residuo de costosa eliminación se han desarrollado otros procedimientos de eliminación del amoníaco, como por ejemplo, el empleo de una solución de dihidrógeno fosfato de amonio o fosfato monoamónico (MAP de las siglas en inglés MonoAmmonium Phosphate).
El gas pasa luego a una columna de absorción donde el cianuro de hidrógeno es absorbido en contracorriente con agua fría y la solución estabilizada por adición de ácido. Finalmente en un rectificador se expulsa el ácido cianhídrico de la solución acuosa y se condensa para producir cianuro de hidrógeno de alta pureza con un contenido acuoso inferior al 0,5 %.
Método BMA-Degussa
El método BMA o método Degussa es un proceso químico desarrollado por la compañía química alemana Degussa para la producción de cianuro de hidrógeno a partir de metano y amoníaco, en presencia de un catalizador de platino, y en ausencia de oxígeno. Las siglas BMA corresponden a los términos alemanes Blausäure (cianuro de hidrógeno) a partir de Methan (metano) y Ammoniak (amoníaco). En el método BMA-Degussa la reacción de formación del cianuro de hidrógeno es una reacción endotérmica que requiere altas temperaturas (por encima de los 1200 °C):
CH4 + NH3 → HCN + 3 H2
El cambio de entalpía para esta reacción es ΔH = +251 kJ/mol.
Al igual que en el método Andrussow, se requiere posteriormente eliminar el amoníaco y aislar el cianuro de hidrógeno.
Si hay dificultades para el suministro de metano, el proceso puede llevarse a cabo con otros hidrocarburos licuados o incluso etanol, o en una reacción de tres etapas con metanol.
Método Shawinigan
El método Shawinigan desarrollado en 1960 por la empresa Shawinigan Chemicals también se conoce como método Fluohmic, y produce HCN a partir de amoníaco e hidrocarburos (metano, pero habitualmente propano y butano) en una reacción no catalítica, libre de oxígeno. El proceso, primera aplicación comercial del reactor «FLUOHMIC», ofrece bajos costos de producción y facilidad de operación. En un reactor refractario, una mezcla de amoníaco e hidrocarburo (relación N/C ligeramente > 1) pasa a través de un lecho fluidizado de carbón calentado eléctricamente a unas temperaturas del orden de 1350-1650 °C:
La reacción podría describirse como:
C3H8 + 3 NH3 → 3 HCN + 7 H2
El cambio de entalpía para esta reacción es ΔH = +634 kJ/mol.
La metionina, un aminoácido esencial
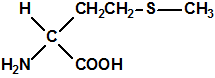 |
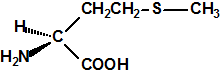 |
| D,L-metionina, CAS 59-51-8 | L-metionina, CAS 63-68-3 |
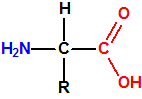
La metionina es el ácido 2-amino-4-(metiltio) butírico ó ácido 2-amino-4-(metiltio) butanoico, de fórmula empírica C5H11NO2S y peso molecular 149,21. Es un polvo blanco y cristalino, que funde a 281-283 °C, con descomposición. Al tener en su molécula un átomo de carbono asimétrico presenta isomería óptica, de modo que tenemos el isómero L-metionina, el isómero D-metionina y la mezcla racémica o racemato D,L-Metionina. La L-metionina es el ácido (S)-2-amino-4-(metiltio) butanoico (CAS 63-68-3), la D-metionina es ácido (R)-2-amino-4-(metiltio) butanoico (CAS 348-67-4) y la D,L-Metionina es la mezcla racémica (CAS 59-51-8).
El término aminoácido viene a indicar que la molécula contiene un grupo amino, -NH2, y un grupo «ácido», en principio cualquier grupo «ácido», pero casi siempre un grupo ácido carboxílico, -COOH.
Tanto el carboxilo como el amino son grupos funcionales susceptibles de ionización dependiendo del valor de pH, de modo que los aminoácidos a valores bajos de pH se encuentran mayoritariamente en su forma catiónica (con carga positiva), mientras que a valores altos de pH se encuentran en su forma aniónica (con carga negativa).
En condiciones fisiológicas normales, esto es, a valores de pH neutro, el grupo carboxilo dona un protón que es aceptado por el grupo amino, de manera que se forma un «zwitterión». Un zwitterión (del alemán «zwitter» «híbrido», «hermafrodita») es un compuesto químico eléctricamente neutro pero que tiene cargas formales positivas y negativas sobre átomos diferentes. Los zwitteriones son especies polares que normalmente son muy solubles en agua y poco solubles en disolventes apolares. Los zwitteriones son moléculas que contienen grupos ácidos y grupos básicos (y son, por tanto, anfóteros) existiendo como iones dipolares en ciertos intervalos de pH. El pH al cual todas las moléculas están en la forma de ion dipolar se conoce como punto isoeléctrico de la molécula.
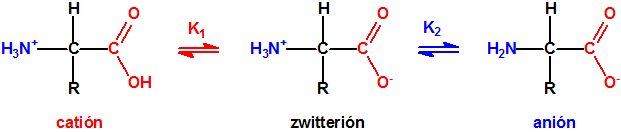 Los valores de pKa de metionina son pK1=2,28 (-COOH) y pK2=9,21 (-NH3+), y su punto isoeléctrico es 5,74 (pH=5,74).
Los valores de pKa de metionina son pK1=2,28 (-COOH) y pK2=9,21 (-NH3+), y su punto isoeléctrico es 5,74 (pH=5,74).
Las proteínas, componentes esenciales de todas las células vivas, por hidrólisis se desdoblan liberando los aminoácidos, y en el organismo, estos mismos aminoácidos se emplean para obtener proteínas. Las proteínas contienen normalmente unos 20 aminoácidos distintos, que se diferencian en la naturaleza del radical R. Aunque hay una clasificación de los aminoácidos bastante aceptada, que los incluyen en cuatro grupos distintos en función de carácter ácido-base y de la polaridad del radical R, nosotros nos vamos a referir a una clasificación más sencilla, esenciales y no esenciales, en función de si se necesita su aporte con la alimentación o no.
Los aminoácidos «esenciales» o «imprescindibles», que el propio organismo no puede sintetizar por sí mismo y que deben ser aportados con la alimentación varía difiere de una especie animal a otra. Así, por ejemplo, para el hombre resultan esenciales valina, leucina, isoleucina, lisina, metionina, treonina, fenilalanina y triptófano. A veces también se incluyen la histidina y la arginina. Para el cerdo se reconocen unos doce aminoácidos esenciales, que deben ser aportados en la dieta: lisina, metionina, cistina, triptofano, treonina, leucina, isoleucina, valina, histídina, arginina, fenilalanina y tirosina.
En las proteínas de origen animal los aminoácidos se presentan en la forma L (levógira) aunque las distintas especies animales disponen de diferentes sistemas enzimáticos capaces de transformar la forma D (dextrógira) en la forma L (levógira).
La metionina, su sigla es Met, se comercializa actualmente en dos formas: la DL-metionina y el análogo hidroxilado de la metionina, el ácido 2-hidroxi-4-metilmercapto butírico ó HMB ó ácido DL-2-hidroxi-4-metiltiobutanoico ó MHA. A partir del hidroxi análogo de la metionina se obtiene y comercializa la sal cálcica correspondiente.
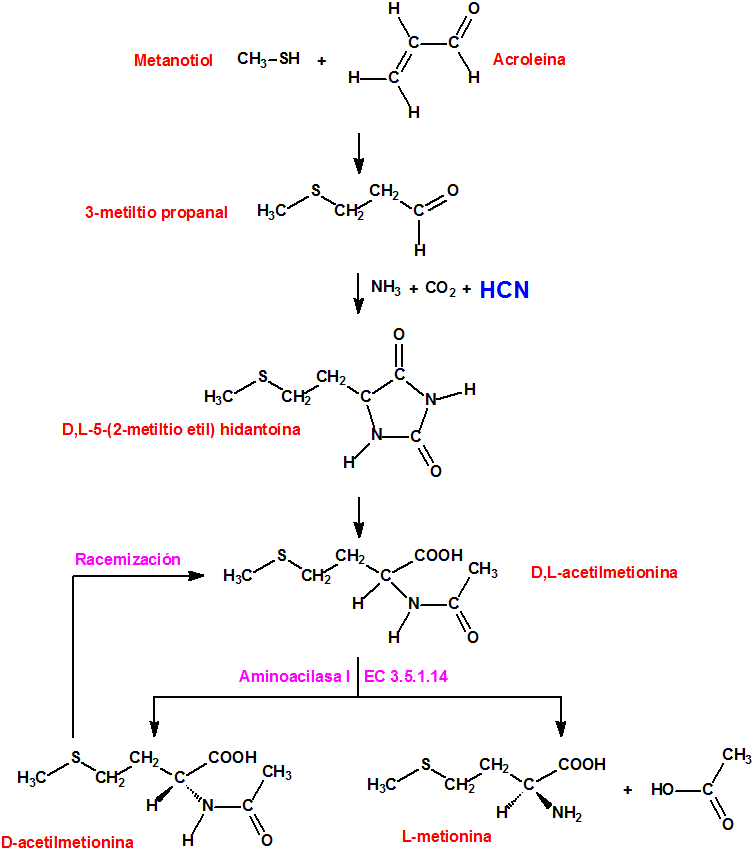
La DL-Metionina se produce a escala industrial mediante síntesis química. El metanotiol reacciona con acroleína para producir 3-metiltio propionaldehído, el cual reacciona con cianuro de hidrógeno para producir 2-hidroxi 4-metiltio butironitrilo, el cual tratado con amoníaco produce en una posterior hidrólisis metionina. El producto comercial sólido tiene una riqueza en metionina superior al 99%.
Método Degussa para la síntesis de L-metionina
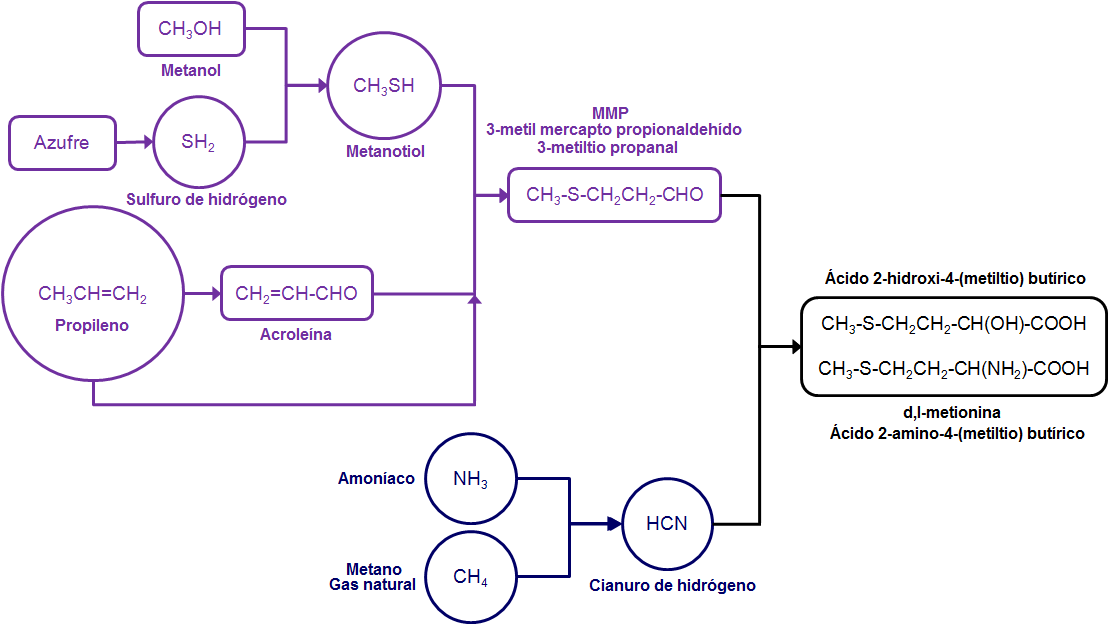
Esquema simplificado de la producción de metionina (Rhodimet) del grupo Bluestar Adisseo.
La materia primas más críticas y que constituyen el principal valor para el proceso son, por este orden, el propileno, el metano y el azufre.
La capacidad mundial de producción de metionina ha ido durante estos últimos años en continuo crecimiento:
|
Capacidad mundial anual de producción de metionina (Fuente: Fountain Agricouncil 2010) |
|
| 2009 | 803000 tm |
| 2010 | 834000 tm |
| 2011 | 916000 tm |
| 2012 | 1046000 tm |
| 2013 | 1111000 tm |
| 2014 | 1187000 tm |
| 2015 | 1267000 tm |
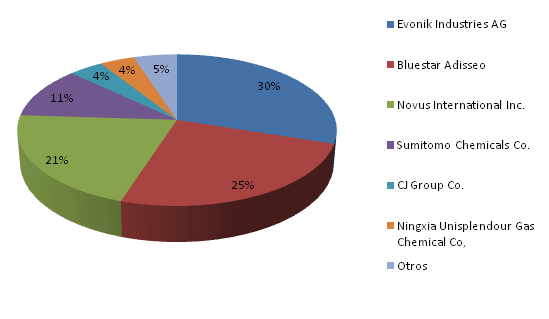
Los principales productores de metionina (datos del año 2015) son:
En España, el grupo Bluestar Adisseo tiene en Burgos una planta de producción de metionina, con una capacidad de producción de al menos 105000 tm al año (datos del año 2005).
Referencias
- «Convención sobre la Prohibición del Desarrollo, la Producción, el Almacenamiento y el Empleo de Armas Químicas y sobre su Destrucción (CAQ)», disponible en https://www.opcw.org/fileadmin/OPCW/CWC/CWC_es.pdf y en https://www.opcw.org/fileadmin/OPCW/CWC/CWC_es.doc
- «The Manufacture of Hydrocyanic Acid by the Andrussow Process», J. M. Pirie, Platinum Metals Rev., 1958, 2, (l), 7-11, http://www.technology.matthey.com/pdf/pmr-v2-i1-007-011.pdf
- «Cyano Compounds, Inorganic», Ullmann’s Encyclopedia of Industrial Chemistry,7th ed., 2011
- «Aminoacids», Ullmann’s Encyclopedia of Industrial Chemistry,7th ed., 2011
- «The complex process of manufacturing methionine», Dick Ziggers, http://www.allaboutfeed.net/Processing/General/2011/10/The-complex-process-of-manufacturing-methionine-AAF012677W/
- «Synthetic methionine saves resources», Michael Binder, http://www.allaboutfeed.net/PageFiles/10642/001_boerderij-download-AAF10450D01.pdf
- «Methionine production – a critical review», Thomas Willke, http://www.thuenen.de/media/institute/at/Personen_Fotos/Wissenschaftler/Download_Methionin-Review-offprint.pdf
- «CCM: Adisseo methionine business boosts revenue in 2015», http://www.cnchemicals.com/Press/84116-CCM:%20Adisseo%20methionine%20business%20boosts%20revenue%20in%202015.html
- «Manual de bioquímica», P.Karlson, Ed. Marín S.A., 4ª edición, 1973