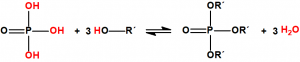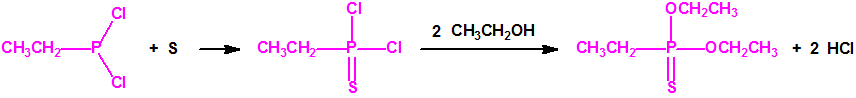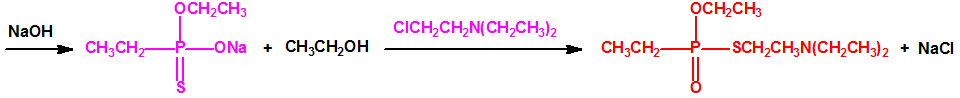El diccionario de la lengua española define alquimia como1:
«Alquimia: Del árabe hispánico alkímya, este del árabe clásico kīmiyā[‘], y este del griego χυμεία chymeía ‘mezcla de líquidos’.
1. f. Conjunto de especulaciones y experiencias, generalmente de carácter esotérico, relativas a las transmutaciones de la materia, que influyó en el origen de la ciencia química y tuvo como fines principales la búsqueda de la piedra filosofal y de la panacea universal.»
Para otros autores la palabra alquimia proviene de la preposición árabe «al» que significa sublime, excelente, y del término «química», de modo que la alquimia vendría a ser la química sublime o la química por excelencia2.
La alquimia, que por tradición siempre ha sido un arte oculto, hermético, y reservado solo a iniciados, también sería la química hermética, en honor a su fundador Hermes Trimegisto2.
El diccionario de la lengua española define hermético como3:
«hermético, ca»:Del lat. mediev. hermeticus, y este der. del lat. tardío Hermes [Trismegistus] ‘Hermes [Trimegisto]’, nombre griego del dios egipcio Tot, a quien le atribuyeron conocimientos esotéricos y de alquimia.
- adj. Que se cierra de tal modo que no deja pasar el aire u otros fluidos.
- adj. Impenetrable, cerrado, aun tratándose de algo inmaterial.
- adj. Dicho de una corriente filosófico-religiosa: Seguidora de los escritos atribuidos a Hermes Trimegisto.
Y según el Oxford Living Dictionaries, hermético (hermética) también se refiere a4:
- Que cierra perfectamente de modo que no deja pasar el aire ni el líquido.
- Que es difícil de conocer, entender o descifrar.
- De Hermes Trimegisto (hipotético filósofo egipcio de la Antigüedad a quien se atribuye la invención de la alquimia) o relacionado con él.
La Alquimia pretende la elaboración de lo que tradicionalmente se ha llamado «piedra filosofal» o «piedra de los filósofos». Durante la Edad Media y el Renacimiento a la posesión de la «piedra filosofal» se le atribuía la posesión de la riqueza (transmutación en oro), la salud (vida eterna) y la sabiduría2.
Ahora, en pleno siglo XXI, la alquimia retorna en la síntesis binaria del VX, ese famoso agente químico de guerra perteneciente a los agentes neurotóxicos persistentes.
El arsenal químico declarado por la República Árabe Siria y el asesinato de Kim Jong-nam en el aeropuerto de Kuala Lumpur contienen aspectos químicos que se asemejan más a la alquimia por eso de ser «difíciles de conocer, entender o descifrar». Las reacciones químicas que parecen estar implicadas en la síntesis binaria del agente VX parecen más, reacciones de «transmutación» propias de un alquimista, que difíciles reacciones se síntesis propias de un buen químico orgánico. Recordemos que la química es una ciencia experimental, y no parece que los datos experimentales apoyen las síntesis binarias propuestas, tal y como veremos a continuación.
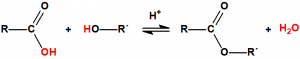
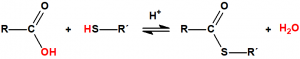
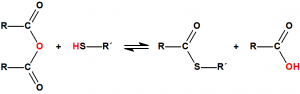
Esterificación5
Se denomina esterificación al proceso por el cual se sintetiza un éster. Un éster es un compuesto derivado formalmente de la reacción química entre un ácido carboxílico y un alcohol. Cuando se habla de ésteres suele ser para referirse a los ésteres de los ácidos carboxílicos, pero en principio pueden formar ésteres prácticamente todos los oxiácidos inorgánicos, por ejemplo, los ésteres fosfóricos, de gran importancia en bioquímica, derivan del ácido fosfórico:
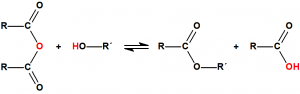
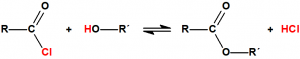
En general, este procedimiento requiere de temperaturas elevadas y de tiempos de reacción largos, y presenta numerosos inconvenientes, por lo que suelen utilizarse derivados del ácido más activos, como los anhídridos de ácido o los cloruros de ácido:
La reacción de la esterificación puede describirse como el ataque nucleofílico del oxígeno del alcohol sobre el carbono del grupo carboxílico, de modo que el protón del alcohol migra al grupo hidroxilo del ácido y luego es eliminado como agua.
Los tioésteres se puede preparar de la misma manera que oxiésteres, empleando un tiol en lugar de un alcohol:
Síntesis del VX6,7,8
Todos los procedimientos registrados para la síntesis de los agentes neurotóxicos de la familia del VX (Lista 1A.3 de la CAQ, alquilfosfonotiolatos) pasan por la obtención de diclorometilfosfina (CH3PCl2, número CAS 676-83-5) o, más raramente, de dicloroetilfosfina (CH3CH2PCl2, número CAS 1498-40-4) como productos intermedios. A partir de la correspondiente dicloroalquilfosfina es posible utilizar varias rutas de síntesis6:
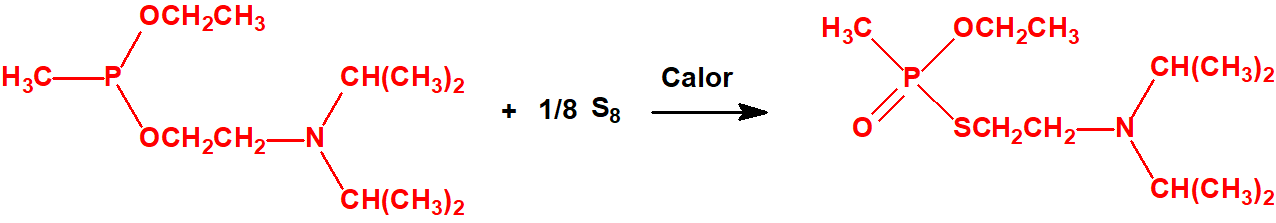
Si se emplea el método conocido como «transesterificación», se obtiene primero el correspondiente dialquil metilfosfonito, por ejemplo, el O,O´-dietil metilfosfonito que luego es transesterificado por calentamiento con el correspondiente N,N-dialquilaminoetanol, por ejemplo, con N,N-diisopropilaminoetanol, para obtener el correspondiente O-(2-dialquilaminoetil) alquilfosfonito de O-alquilo, por ejemplo, el O-(2-diisopropilaminoetil) metilfosfonito de O-etilo (QL, número CAS 57856-11-8), el cual reacciona con azufre elemental o con polisulfuro de dimetilo, y mediante calentamiento tiene lugar el reordenamiento tiono-tiolo que conduce a la formación del correspondiente agente neurotóxico de guerra, VX en nuestro caso6,7,8.
Síntesis completa del VX mostrando la etapa final que constituye la síntesis binaria empleada en las municiones químicas
Las otras rutas que parten también de la correspondiente dicloroalquilfosfina conducen, o bien a la obtención del correspondiente O,O´-dialquil alquilfosfonotionato, que luego es hidrolizado al correspondiente ácido O-alquil alquilfosfonotióico, o bien a la obtención de dicho ácido O-alquil alquilfosfonotióico. La posterior alquilación del tioácido con la correspondiente 2-cloroetil (N,N-dialquilamina) bajo condiciones básicas produce el correspondiente agente neurotóxico con un buen rendimiento. La alquilación puede realizarse en condiciones acuosas o en disolventes orgánicos (por ejemplo en acetona o en benceno). Condiciones acuosas proporcionan mejores rendimientos y productos más puros excepto para los N,N-dimetilamino derivados, para los cuales se prefiere benceno como disolvente6.
Obtención del agente VE partiendo de diclorometilfosfina
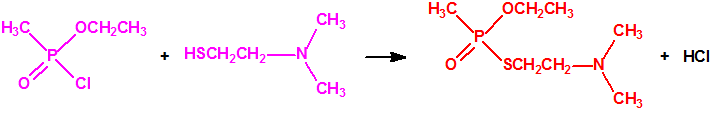
Obtención del S-(2-dimetilaminoetil) metilfosfonotiolato de O-etilo a partir de los correspondientes alquilfosfonocloridato y N,N-dialquilaminoetanotiol
Los alquimistas de la OPAQ9,10,11
Hace ya varios años en 2013, la OPAQ, con motivo de la destrucción de las armas químicas sirias, empleaba una «química hermética». En su trigésima cuarta reunión, el Consejo Ejecutivo adoptaba una decisión en la que se establecían los requisitos detallados para la destrucción de las armas químicas sirias y las instalaciones de producción de armas químicas sirias (EC-M-34/DEC.1, de fecha 15 de noviembre de 2013).
En esa decisión consideraba, entre otras cosas, los motivos por los que la República Árabe Siria proponía que la destrucción de sus armas químicas tendría que llevarse a cabo fuera de su territorio y establecía los plazos para su retirada y destrucción fuera del territorio de la República Árabe Siria9,10:
«a) para el agente mostaza y los componentes binarios clave de armas químicas DF, A, B y BB, incluida la sal BB, declarados por la República Árabe Siria: retirada del territorio de la República Árabe Siria no más tarde del 31 de diciembre de 2013. Para estas sustancias químicas, la destrucción debe comenzar lo antes posible, teniendo lugar la destrucción efectiva no más tarde del 31 de marzo de 2014, y la destrucción de las masas de reacción resultantes debe tener lugar en una fecha que habrá de convenir el Consejo, a partir de la recomendación del Director General en relación con el plan para la destrucción; y
b) para todas las demás sustancias químicas declaradas por la República Árabe Siria: retirada del territorio de la República Árabe Siria no más tarde del 5 de febrero de 2014, con la salvedad de que el isopropanol se destruirá en la República Árabe Siria no más tarde del 1 de marzo de 2014. Para estas sustancias químicas, la destrucción debe comenzar lo antes posible y debe concluir no más tarde del 30 de junio de 2014.»
El DF (metilfosfonildifluoruro, número CAS 676-99-3) es considerado en la CAQ, arma química de «categoría 1» y fue denominado «sustancia de prioridad 1» por el Director General de la OPAQ pues forma parte del sistema binario para la síntesis del sarín.
El componente binario clave «A», sería según todas las hipótesis el O-etil metilfosfonotioato de sodio, con número CAS 22307-81-9, incluido en Lista 2B.4 y considerado en la CAQ como arma química de «categoría 2». También fue considerado «sustancia de prioridad 1» por el Director General de la OPAQ, pero no forma parte de sistema binario alguno conocido. Los otros componentes binarios clave «B» y «BB» serían respectivamente, según todas las hipótesis el clorhidrato de dietil cloroetilamina (número CAS 869-24-9, incluido en Lista 2B.10) y el clorhidrato de diisopropil cloroetilamina (número CAS 4261-68-1, incluido en lista 2B.10). Ambas sustancias son consideradas en la CAQ como armas químicas de «categoría 2» y también fueron denominados «sustancias de prioridad 1» por el Director General de la OPAQ, pero ninguno de ellas forma parte de un sistema binario conocido para la obtención de VM y VX,
Según parece los alquimistas de turno suponían que los componentes del sistema binario del VX y del VM eran el O-etil metilfosfonotioato de sodio (también conocido como EMPTA, CAS 22307-81-9), sustancia incluida en la Lista 2B.4 de la CAQ y el correspondiente cloruro de 2-aminoetil-N,N-dialquilo
Obtención de VX a partir del O-etil metilfosfonotioato de sodio y el clorhidrato de diisopropil cloroetilamina
Obtención de VM a partir del O-etil metilfosfonotioato de sodio y el clorhidrato de dietil cloroetilamina
Por el simple hecho de que sean dos precursores los que participan en la síntesis final del agente químico de guerra, el sistema no tiene por qué ser lo que se entiende por un sistema binario.
El sistema binario conocido por los químicos emplea los precursores de Lista 1B.10 de la CAQ, el O-(2-dietilaminoetil) metilfosfonito de O-etilo (número CAS 55523-55-2) para el VM, y el O-(2-diisopropilaminoetil) metilfosfonito de O-etilo (QL, número CAS 57856-11-8) para el VX.
Sistema binario para la obtención de VM
Sistema binario para la obtención de VX
En relación también a la destrucción de las armas químicas declaradas por Siria, en un artículo acerca de la toxicidad y respuesta médica frente a los agentes neurotóxicos VM y VX publicado en 2015, los autores del mismo indican que mezclando en solución acuosa el O-etil metilfosfonotioato de sodio con el correspondiente precursor químico, clorhidrato de dietil cloroetilamina para el VM o clorhidrato de diisopropil cloroetilamina para el VX, se obtiene el correspondiente agente neurotóxico de elevada toxicidad11.
Sin embargo para su estudio, ellos obtienen el VM y el VX mediante cloración del metilfosfonato de O,O-dimetilo con cloruro de oxalilo (número CAS 79-37-8) para conseguir el metilfosfonocloridato de O-etilo (número CAS 5284-09-3), que posteriormente hacen reaccionar con N,N-dietilaminoetanotiolato de litio o con N,N-diisopropilaminoetanotiolato de litio para obtener, el VM o el VX, respectivamente11:
Obtención de VM11
Obtención de VX11
Pero tampoco en este caso podemos hablar de sistema binario.
Las asesinas alquimistas12,13
La alquimia aparece también en el asesinato, el día 14 de febrero de 2017, de Kim Jong-nam, hermano del líder norcoreano Kim Jong-Un. Según describen Nakagawa & Tu en un artículo de reciente aparición13, al principio nadie sabía quién había asesinado al Sr. Kim Jong-nam, ni con qué tipo de veneno y ni con qué propósito. El asesinato que lugar en el concurrido aeropuerto de Kuala Lumpur, la capital de Malasia, a plena luz del día, fue perpetrado por dos mujeres, que primero una, y luego otra, frotaron con sus manos la cara de la víctima. Inicialmente se informó de que el veneno empleado había sido metil paratión, un potente insecticida organofosforado, pero posteriormente la policía de Malasia informó que se había encontrado VX en el cuerpo de Kim Jong-nam.
Lo sorprendente fue el escaso tiempo empleado por las dos mujeres para frotar con las dos manos la cara de Kim, con tan solo 7 segundos de separación la una de la otra. Si en verdad se trataba de VX, ¿cómo pudieron las mujeres aplicar con sus manos desnudas un agente neurotóxico letal? Puesto que la policía de Malasia informó que no había encontrado rastro alguno del precursor binario del VX, el QL (O-(2-diisopropilaminoetil) metilfosfonito de O-etilo), resulta obvio, dicen los autores, que las asesinas debieron emplear un sistema binario del VX modificado13.
Los minuciosos análisis químicos realizados por el gobierno de Malasia indican que Kim Jong-nam murió por la acción del VX. Realizada la auptosia, los compuestos hallados en su cuerpo y en su ropa fueron, además del agente neurotóxico VX, cloruro de 2-(diisopropilamino)etilo, 2-(diisopropilamino) etanotiol, ácido O-etil metilfosfonotióico, ácido O-etil metilfosfónico, sulfuro de bis(2-diisopropilaminoetilo), disulfuro de bis(2-diisopropilaminoetilo) y 2-(dimetilamino)etanol13.
También se realizaron análisis químicos detallados a las dos mujeres, la vietnamita Doan Thi Huong, y la indonesia Siti Aisyah, resultando que los compuestos identificados en Kim Jong-nam y en las dos mujeres eran diferentes en cada uno de los casos, y según dice el artículo altamente sugerente de tratarse de un sistema binario13.
Resulta ciertamente extraño que los compuestos identificados en las dos mujeres resultaran drásticamente diferentes, como muestra la siguiente tabla. Si no hubo un sistema binario de VX, el asesinato debió producirse con el propio agente VX, y en ese caso los compuestos hallados en las dos mujeres deberían haber sido los mismos13.
| Sustancia identificada | Kim Jong-nam | Mujer vietnamita | Mujer indonesia |
| VX | √ | √ | |
| Cloruro de 2-(diisopropilamino)etilo | √ | √ | |
| 2-(diisopropilamino)etanotiol | √ | √ | |
| Ácido O-etil metilfosfonotióico | √ | ||
| Ácido O-etil metilfosfónico | √ | √ | |
| Sulfuro de bis(2-diisopropilaminoetilo) | √ | ||
| Disulfuro de bis(2-diisopropilaminoetilo) | √ | √ | |
| 2-(dimetilamino)etanol | √ |
Tabla resumen de los compuestos químicos identificados en la víctima y en las dos mujeres acusadas del asesinato extraída del artículo de Nakagawa & Tu
A partir de estos datos, los autores del artículo sugieren que se podría haber utilizado ácido O-etil metilfosfónico y 2-(diisopropilamino)etanotiol para generar VX en la cara de Kim Jong-Nam, con ayuda de algún catalizador, pero no aportan datos adicionales, ni resultados experimentales que apoyen esta posibilidad13:
Reacción indicada por Nakagawa & Tu para la síntesis del VX
A partir de estos mismos datos, existiría también la posibilidad de obtener VX a partir del ácido O-etil metilfosfonotióico y del cloruro de 2-(diisopropilamino)etilo:
Otra posible reacción de síntesis de VX a partir de los compuestos identificados
No creo sin embargo que estas reacciones constituyan un sistema binario, que permita la obtención de VX por el simple frotamiento de los precursores con la piel de la víctima. Todo apunta a que la vietnamita Doan Thi Huong, y la indonesia Siti Aisyah serían unas excelentes alquimistas.
Químicos versus alquimistas
La bibliografía consultada acerca de la síntesis del VX (y del VM) no menciona ningún sistema de síntesis binaria que incluya las reacciones que supuestamente conducirían a la síntesis del VX (y del VM) a partir de los precursores declarados por la República Árabe Siria, o a partir de los compuestos identificados en asesinato de Kim Jong-nam. La química (los químicos) no ha conseguido aclarar estos dudosos aspectos de síntesis binaria, de modo que en estos casos la síntesis del VX parece cosa de alguna transmutación propia de alquimistas, de ahí el título… VX: el retorno de la alquimia.
Referencias
- «Alquimia», Diccionario de la lengua española, RAE, http://dle.rae.es/?id=25KSS9r
- «Alquimia, tras la piedra filosofal», Luis Silva
- «Hermético, ca», Diccionario de la lengua española, RAE, http://dle.rae.es/?id=KDbHSLX
- «Hermético», Oxford Living Dictionaries, https://es.oxforddictionaries.com/definicion/hermetico
- «Esterificación», https://es.wikipedia.org/wiki/Esterificaci%C3%B3n
- «The chemistry of organophosphorus chemical warfare agents», M. Black & J. M. Harrison, en PATAI’S Chemistry of Functional Groups, The Chemistry of Organophosphorus Compounds: Ter‐ and Quinque‐Valent Phosphorus Acids and Their Derivatives, Volume 4, pages 781-840, Wiley 1996
- «A Laboratory History of Chemical Warfare Agents», Jared Ledgard
- «VX (nerve agent)», https://en.wikipedia.org/wiki/VX_(nerve_agent)
- «La realidad sobre la destrucción de las armas químicas sirias», J. Domingo-René Pita, DIEEEO014-2015, http://www.ieee.es/Galerias/fichero/docs_opinion/2015/DIEEEO14-2015_ArmasQuimicas-Siria_J.DomingoRenePita.pdf
- «Plan for the destruction of the syrian chemical weapons outside the territory of the Syrian Arab Republic», OPAQ, EC-M-36/DG.3, de 15 de diciembre de 2013, https://dokumen.tips/download/link/opcw-plan-for-destroying-syrias-chemical-weapons
- «Toxicity and medical countermeasure studies on the organophosphorus nerve agents VM and VX», Helen Rice, Christopher H. Dalton,Matthew E. Price, Stuart J. Graham,A. Christopher Green, John Jenner,Helen J. Groombridge and Christopher M. Timperley, Proceedings Mathematical, Physical, and Engineering Sciences / The Royal Society. 2015;471(2176):20140891
- «Matando moscas a cañonazos», J. Domingo, https://cbrn.es/?p=855
- «Murders with VX: Aum Shinrikyo in Japan and the assassination of Kim Jong-Nam in Malaysia», Tomomasa Nakagawa & Anthony T.Tu, Forensic Toxicology 36(2), May 2018