Punto de fusión
El punto de fusión se puede definir como la temperatura a la que el sólido se transforma en líquido a la presión de una atmósfera (760 mm de Hg). Para una sustancia pura este cambio de estado es muy rápido y varía muy poco ante cambios moderados de presión, de modo que el punto de fusión puede ser utilizado para tratar de identificar una sustancia. Además, si la sustancia no es pura, pues contiene impurezas, el punto de fusión disminuye (y aumenta el intervalo de fusión), hecho que puede utilizarse como criterio de pureza.
Cuando una sustancia pura en estado líquido se enfría de tal forma que se evita el sub-enfriamiento, solidifica a la misma temperatura a la que el sólido funde.
Por ello también se define el punto de fusión (y el punto de solidificación) como la temperatura a la que coexisten en equilibrio la fase sólida y la fase líquida a la presión de una atmósfera.
Punto de sublimación
A veces se encuentran sustancias, como por ejemplo, el hexafluoruro de uranio, ya citado en un artículo anterior1, o el hexacloroetano, que cuando se calientan en vez de fundir y pasar a estado líquido, aumentan su tensión de vapor de tal manera, que ésta rápidamente alcanza el valor de 760 mm de Hg, y pasan directamente al estado gaseoso. El punto de sublimación puede definirse como la temperatura a la cual la presión de vapor de un sólido alcanza el valor de una atmósfera (760 mm de Hg).
Punto de ebullición
Cuando una sustancia líquida se introduce en un recipiente cerrado y vacío, se evapora (pasa al estado gaseoso) hasta que el vapor alcanza una determinada presión, que depende sólo de la temperatura. Esta presión, que es la ejercida por el vapor en equilibrio con el líquido, es la presión de vapor de la sustancia a esa temperatura. El punto de ebullición puede definirse como la temperatura a la cual la presión de vapor de una sustancia alcanza el valor de una atmósfera (760 mm de Hg).
El punto de ebullición depende del peso molecular de la sustancia y de las fuerzas intermoleculares existentes, de modo que en una serie homóloga los puntos de ebullición normalmente aumentan al aumentar el peso molecular, y para pesos moleculares similares, las sustancias polares presentan puntos de ebullición más altos que las sustancias apolares.
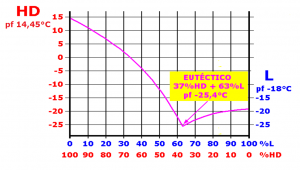
Eutécticos y punto eutéctico
Consideremos dos sustancias, A y B, miscibles en estado líquido. La presencia en la sustancia A de cantidades crecientes de la sustancia B (impureza) provoca una disminución creciente del punto de fusión (punto de solidificación) de la sustancia A (mezcla A+B). Análogamente, la presencia en la sustancia B de cantidades crecientes de la sustancia A (impureza) provoca una disminución creciente del punto de fusión (punto de solidificación) de la sustancia B (mezcla B+A). Ambos procesos confluyen en un punto, denominado punto eutéctico, donde la temperatura alcanza un valor mínimo (temperatura eutéctica) y la mezcla de las sustancias A y B (mezcla eutéctica) funde (solidifica) como si se tratase de una sustancia pura.
Desde el punto de vista NBQ se prefieren los agentes químicos en estado líquido, dado que se manejan y dispersan mejor, así que algunas mezclas eutécticas pueden resultar muy interesantes según las circunstancias.
Tal es el caso de la mezcla vesicante HL, con un 37 % de iperita (HD, con un punto de fusión de 14,45 °C), y un 63 % de lewisita (L, con un punto de fusión de -18 °C) que presenta un punto eutéctico a -25,4 °C. La lewisita actúa como anticongelante, y la mezcla se comporta como una sustancia pura que puede utilizarse en zonas de gran altitud y bajas temperaturas, en estado líquido2.
Azeótropos y punto azeotrópico
En 1887 el físico y químico francés Francois-Marie Raoult estudió la presión de vapor en las disoluciones y enunció la ley que lleva su nombre. Según la ley de Raoult la disminución relativa de la presión de vapor (a la misma temperatura), de un líquido volátil al disolver en él un soluto no salino cualquiera, es igual a la fracción molar del soluto. Además este aumento de la temperatura de ebullición de la disolución depende de la concentración del soluto (no salino) y de la naturaleza del disolvente.
Para que una mezcla de dos sustancias químicas líquidas se comporte como una disolución ideal, y cumpla la ley de Raoult, las moléculas de ambas sustancias deben ser similares. De este modo el entorno de cualquier molécula en la disolución no difiere apreciablemente del que existe en las sustancias puras, y entonces la presión de vapor parcial de cada una de las sustancias es proporcional al número de moléculas de la misma en la fase líquida.
Si los constituyentes de la mezcla son de naturaleza apreciablemente diferente aparecen desviaciones con respecto al comportamiento ideal, esto es, con respecto a la ley de Raoult. Estas desviaciones son habitualmente de tipo «positivo» y la presión de vapor parcial real de cada constituyente es mayor de lo que sería si obedeciese a la ley de Raoult. En una desviación de tipo «negativo», donde las distintas moléculas ejercen una atracción mutua muy fuerte, la presión de vapor parcial real de cada constituyente resulta menor de lo que sería si obedeciese a la ley de Raoult.
Estas desviaciones «positivas» y «negativas» del comportamiento ideal de las disoluciones dan lugar a la formación de azeótropos de ebullición mínima y azeótropos de ebullición máxima. Un azeótropo (o mezcla azeotrópica) es una mezcla líquida de dos o más sustancias químicas que ebulle a temperatura constante, como si fuese una sustancia pura.
Una mezcla de metanol-cloroformo con un 12,6 % de metanol da lugar a un azeótropo de ebullición mínima, que ebulle a 53,43 °C, como si fuese una sustancia pura, cuando metanol puro ebulle a 64,7 °C y el cloroformo lo hace a 61,2 °C.3
Una mezcla de acetona-cloroformo con un 21,5 % de acetona da lugar a un azeótropo de ebullición máxima, que ebulle a 64,43 °C, como si fuese una sustancia pura, cuando la acetona pura ebulle a 56,1 °C y el cloroformo lo hace a 61,2 °C.3
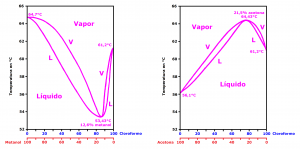
Desde el punto de vista NBQ la formación de un azeótropo entre un agente químico de guerra y un disolvente puede resultar interesante a pesar de diluir la concentración del agente y con ello su toxicidad. La formación de un azeótropo de ebullición mínima podría favorecer la evaporación del agente para facilitar así su inhalación, mientras que la formación de un azeótropo de ebullición máxima disminuiría la evaporación del agente aumentando su persistencia.
Referencias
- El flúor 19, J. Domingo, cbrn.es, 2 de junio de 2015
- Compendium of Chemical Warfare Agents, Steven L. Hoenig, Springer Science & Business Media, 2006
- Química general moderna, J.A. Babor y J.I. Aznárez, Editorial Marín