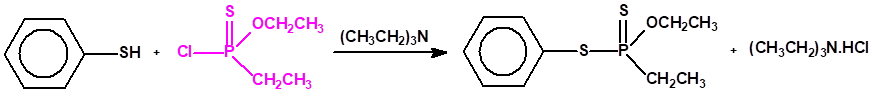Introducción1
En 1967 la compañía Stauffer Chemical Co., introducía en el mercado el Fonofos, un insecticida organofosforado de aplicación en el suelo, utilizado hasta hace muy poco para controlar diversas plagas como la del gusano de la raiz del maiz, los gusanos cortadores, los sínfilos (Symphyla, una clase de miriápodos de pequeño tamaño que habitan los lugares húmedos) y los gusanos del alambre. El Fonofos pasó más tarde a la compañía Zeneca Ag Products la cual solicitó voluntariamente la cancelación del registro en EPA el 18 de diciembre de 1997.
Utilizado principalmente en cultivos de maíz, el fonofos también se utiliza en otros cultivos como espárragos, judías, remolacha, cebollas, pimientos, tomates, coles, guisantes, menta, plátanos, sorgo, soja, fresas, caña de azúcar, remolacha azucarera, patatas blancas (irlandesas) y tabaco.
El Fonofos es moderadamente persistente en el suelo y su persistencia depende del tipo de suelo, del contenido en materia orgánica, de la lluvia y de la luz solar. Dado que el fonofos se adsorbe moderadamente bien en el suelo, ni se lixivia con facilidad, ni se infiltra al agua subterránea, pero en cambio sí puede, con la escorrentía, transportarse a las aguas superficiales.
El Fonofos es degradado rápidamente por los microorganismos del suelo y tiende a volatilizarse desde los suelos húmedos y las superficies de agua, en un proceso ralentizado por su adsorción sobre el material orgánico del suelo, los sólidos en suspension y los sedimentos.
El Fonofos (como muchos organofosforados) es tóxico para humanos y animales. Los informes de casos y los estudios de toxicidad oral aguda en animales indican que la exposición oral al fonofos induce signos clínicos de toxicidad que son típicos de los inhibidores de la colinesterasa. Los estudios de exposición crónica también indicaron que la administración oral de fonofos inhibe la colinesterasa. La inhibición de la colinesterasa es uno de los efectos críticos asociados con la dosis de referencia (RfD, Reference Dose, dosis oral máxima aceptable de una sustancia tóxica según la Agencia de Protección Ambiental de los Estados Unidos) que la EPA estableció en 0,002 mg/kg/ día. La EPA obtuvo la RfD utilizando un nivel sin efectos adversos observados (NOAEL) de 0,2 mg/kg/día y un factor de 100 en la incertidumbre, para tener en cuenta las diferencias entre especies e intraespecies.
Conforme a las directrices EPA de 1986 para evaluación de riesgos (EPA Risk Assessment Guidelines of 1986) el Fonofos fué clasificado en el grupo «E»-«Evidencia de no carcinogenicidad para humanos», porque los estudios de alimentación a largo plazo, disponibles en ratas y ratones, no mostraron evidencia de carcinogenicidad. El Fonofos no parece ser mutagénico.
Los datos del Centro Nacional de Política Alimentaria y Agrícola (NCFAP, National Center for Food and Agricultural Policy) indican que el uso de fonofos disminuyó significativamente durante la década de 1990. Según el NCFAP, se aplicaron aproximadamente alrededor de 1,59 millones de kilos de Fonofos en el año 1992, y alrededor de 0,18 millones de kilos en 1997.
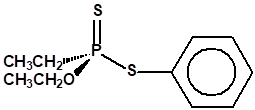
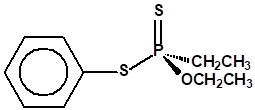
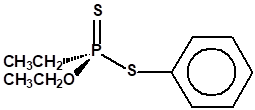
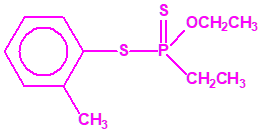
El Fonofos, etilfosfonoditioato de O-etilo y S-fenilo1,2,3,4,5,6,7
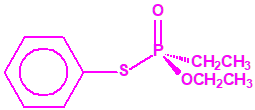
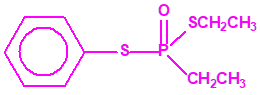
El Fonofos de fórmula empírica C10H15OPS2 es el etilfosfonoditioato de O-etilo y S-fenilo:
Además del nombre común fonofos, se emplean otros sinónimos: fonophos; dyfonate; difonate; dyphonate; ENT 25,796; Stauffer N 2790; N-2790, ethylphosphonodithioic acid, O-ethyl S-phenyl ester; O-ethyl S-phenyl ethyl phosphonothiolothionate; O-Ethyl-S-phenyl ethylphosphonodithioate; O-Ethyl-S-phenyl-(RS)-ethylphosphonodithioate (IUPAC); (±)-O-ethyl S-phenyl ethylphosphonodithioate (Chemical Abtracts); O-Ethyl-S-phenyl ethyldithiophosphonate; Phosphonodithioic acid, ethyl-O-ethyl, S-phenyl ester.
Entre sus productos y mezclas comerciales podemos citar: CAPFOS® (Zeneca); TYCAP CS; CUDGEL® (Zeneca); DIFONATE® (Zeneca); DYFONATE®[C]; DYPHONATE®.
El fonofos es un líquido amarillo pálido y olor acre parecido al de los mercaptanos, que se presenta comercialmente en forma líquida, en gránulos y en concentrados emulsionables. Aunque es poco inflamable, algunas de sus formulaciones líquidas si pueden serlo dependiendo del disolvente portador utilizado.
Tiene un peso molecular de 246,34, con una gravedad específica (H2O=1) de 1,16 a 25 °C (1,154 a 20 °C)6, punto de ebullición de 130 °C a 0,1 mmHg, punto de congelación/fusión de 30 °C, punto de inflamación de 94 °C, solubilidad en agua de 13 mg/l (15,7 mg/l a 20 °C)1 y es miscible con acetona, etanol, metil isobutil cetona, xileno y queroseno.
Su presión de vapor es de 2,1×10-3 mmHg at 25°C (3,38×10–4 mmHg a 25 °C)2. Sirva de comparación que a 25 °C el agua tiene una presión de vapor de 23,776 mmHg, y el agente químico de guerra VX tiene una presión de vapor de 7×10-4 mmHg)
El coeficiente de partición octanol-agua (Kow) utilizado para predecir y modelizar la migración de compuestos orgánicos hidrófobos disueltos en el suelo y en las aguas subterráneas presenta un valor Log Kow de 3,90 a 20 °C (afinidad alta para los tejidos grasos animales). El coeficiente de carbono orgánico (Koc) presenta un Log Koc de 870 y la constante de la ley de Henry un valor de 7,0 ×10-6 atm×m3/mol.
El número CAS 944-22-9 corresponde al Fonofos sin estereoquímica establecida, el número CAS 66767-39-3 corresponde al racemato, y los números CAS 62705-71-9 y 62680-03-9 corresponden, respectivamente, a los enantiómeros (R)P y (S)P. Su número EC es 213-408-0 y su número RTECS es TA5950000.
El Fonofos, como muchos otros compuestos organofosforados utilizados ampliamente como insecticidas y fungicidas y, en cierta medida, como herbicidas, contiene un átomo de fósforo pentavalente con un doble enlace P=S o P=O, y tres enlaces sencillos con tres sustituyentes, dispuestos en una estructura tetraédrica. Cuando los sustituyentes son diferentes entre sí, el «átomo de fósforo» se convierte en un centro quiral y el resultado son dos estructuras enantioméricas8. Se han aislado las diferentes formas quirales del compuesto. El enantiómero (R)P es más tóxico para insectos y ratones, y es un inhibidor de la colinesterasa más potente que el enantiómero (S)P:
|
(S)P-Fonofos |
(R)P-Fonofos |
El rombo de identificación de peligros (basado en el sistema de clasificación NFPA-704 M) presenta los valores de «Salud 4», «Inflamabilidad 1», «Reactividad 0»:
Pero ciertas preparaciones que utilizan un disolvente, como por ejemplo, metanol, pueden mostrar un rombo con los valores de «Salud 1», «Inflamabilidad 3», «Reactividad 0»:
Los compuestos organofosforados en presencia de agentes reductores fuertes como por ejemplo los hidruros, forman fosfina, un gas altamente tóxico e inflamable, mientras que el contacto con agentes oxidantes puede provocar la liberación de óxidos de fósforo, de carácter tóxico, y el contacto con ácidos o álcalis fuertes provoca su hidrólisis.
Cuando se transporta en forma de líquido le corresponde el número ONU 3018 (Plaguicida a base de organofósforo, líquido, tóxico) y cuando se hace en foma sólida el número ONU 2783 (Plaguicida a base de organofósforo, sólido, tóxico), y en ambos casos le corresponde la guía de respuesta a emergencias nº 152 (Sustancias tóxicas-combustibles)
Para su síntesis, se mezclan tiofenol (10,5 g), O-etil-etilfosfonocloridotioato (16,4 g) y acetona (70 ml), y se añade poco a poco trietilamina (10 g), mientras se agita eficazmente. Tiene lugar una reacción exotérmica con la rápida precipitación del clorhidrato de amina. Cuando se ha añadido toda la trietilamina, la mezcla se calienta a reflujo (58 ºC) durante 20 minutos y luego se deja enfriar. Se agrega benceno (70 ml) y la mezcla se lava sucesivamente con agua, NaOH al 3% y nuevamente con agua.
La capa bencénica se separa y se seca con MgSO4 anhidro y luego se elimina el solvente para obtener un producto aceitoso, de color amarillo, con un nD25 de 1,5888, con un rendimiento del 89%. El producto puro se destila a 130-132 °C a una presión de 0,1 mm. Su nD25 es 1,5883.
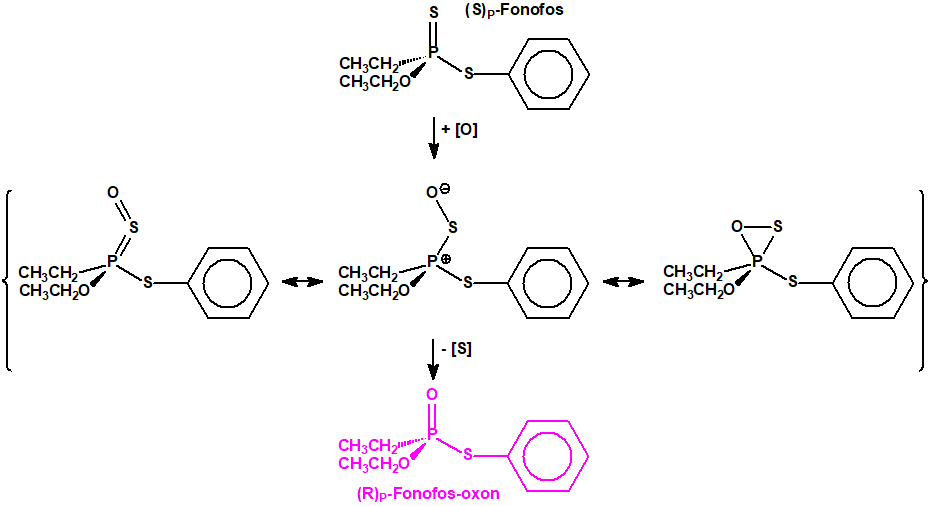
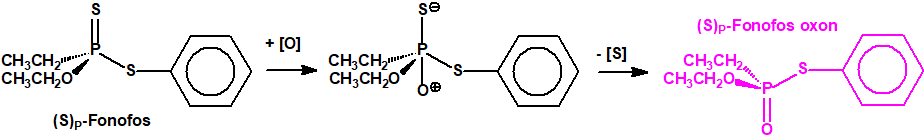
Debido a la disposición espacial, más o menos tetraédrica, de los diferentes enlaces del átomo de fósforo, el Fonofos presenta isomería óptica en el átomo de fósforo. Lo mismo le sucede al Fonofos oxon pero debido a la diferente prelación de los enlaces las configuraciones (R) y (S) son diferentes:
|
(S)P-Fonofos |
(R)P-Fonofos |
|
(R)P-Fonofos oxon |
(S)P-Fonofos oxon |
La toxicidad de los enantiómeros y racematos del Fonofos y del Fonofos Oxon, en moscas domésticas, larvas de mosquitos y ratones blancos se resume en la siguiente tabla11:
|
Compuesto |
Mosca doméstica LD50 (µg/g) |
Larva de mosquito LC50 (ppb) |
Ratón (oral) LD50 (mg/kg) |
Ratón (ip) LD50 (mg/kg) |
|
Fonofos racémico |
12,0 |
31,0 |
14,0 |
4,8 |
|
(S)p Fonofos |
25,0 |
45,0 |
32,0 |
7,5 |
|
(R)p Fonofos |
6,3 |
25,0 |
9,5 |
3,8 |
|
Fonofos oxon racémico |
8,0 |
92,0 |
21,0 |
0,94 |
|
(S)p Fonofos oxon |
4,0 |
50,0 |
6,0 |
0,72 |
|
(R)p Fonofos oxon |
48,0 |
610,0 |
38,0 |
1,86 |
Los compuestos organofosforados como el fonofos y el malatión que contienen un resto P=S requieren activación metabólica por desulfuración oxidativa a la forma P=O (oxon) para que tenga lugar la inhibición enzimática12:
Los estudios indican que el R-(-)-Fonofos tiene una mayor actividad biológica «in vivo» que el (S)-(+)-Fonofos para la mosca doméstica, el mosquito y los ratones. Por el contrario, la interacción directa de los enantiómeros de fonofos-oxon con AChE muestra que el (S)-oxon es entre 2,6 y 12,2 veces más tóxico que el correspondiente (R)-oxon para la misma especie13.
Un privilegiado, la excepción de la Lista 2B.414,15,16
La Convención sobre Armas Químicas (cuyo título completo es «Convención sobre la Prohibición del Desarrollo, la Producción, el Almacenamiento y el Empleo de Armas Químicas y sobre su Destrucción», en adelante, «CAQ» o «Convención»), que entró en vigor el 29 de abril de 1997, es un tratado internacional de control de armas cuyo objeto y propósito es eliminar una categoría completa de armas de destrucción masiva al prohibir el desarrollo, producción, adquisición, almacenamiento, retención, transferencia o uso de armas químicas por los Estados Partes. Los Estados Partes de la CAQ han acordado destruir todas las existencias de armas químicas que puedan tener y las instalaciones que las produjeron, así como todas las armas químicas que hayan abandonado en el territorio de otros Estados Partes. Los Estados Partes de la CAQ también han acordado implementar un régimen integral de declaración, notificación e inspección de datos para los productos químicos tóxicos y sus precursores enumerados en las Listas 1, 2 o 3 del Anexo de la CAQ sobre productos químicos para brindar transparencia y verificar que los sectores públicos y privados no participan en actividades prohibidas por la CAQ14.
En estas tres Listas se enumeran las sustancias químicas tóxicas y sus precursores. A los fines de aplicación de la CAQ, se identifican en esas Listas las sustancias químicas respecto de las que se prevé la aplicación de medidas de verificación con arreglo a lo previsto en las disposiciones del Anexo sobre verificación. Es importante resaltar, que de conformidad con el apartado a) del párrafo 1 del artículo II, estas Listas no constituyen una definición de armas químicas, y más importante aún es lo que se conoce como «criterio de propósito general», por el que ninguna sustancia química puede emplearse para fines prohibidos por la CAQ14.
La CAQ en su artículo I,»OBLIGACIONES GENERALES» establece que todos los Estados Parte en la Convención se comprometen, cualesquiera que sean las circunstancias, a no desarrollar, producir, adquirir de otro modo, almacenar o conservar armas químicas ni a transferir esas armas a nadie, directa o indirectamente y en su artículo II, «DEFINICIONES Y CRITERIOS» define como «armas químicas» a las sustancias químicas tóxicas y sus precursores, salvo cuando se destinen a fines no prohibidos por la presente Convención, siempre que los tipos y cantidades de que se trate sean compatibles con esos fines. En este artículo II también se define lo que se entiende por «sustancia química tóxica» y por «precursor»15.
La implementación de este «criterio de propósito general» la establece el artículo VI, «ACTIVIDADES NO PROHIBIDAS POR LA PRESENTE CONVENCION» que indica que cada Estado Parte tiene el derecho, con sujeción a lo dispuesto en la Convención, a desarrollar, producir, adquirir de otro modo, conservar, transferir y emplear sustancias químicas tóxicas y sus precursores para fines no prohibidos por la CAQ, adoptando las medidas necesarias para garantizar que dichas sustancias químicas tóxicas y sus precursores solamente sean desarrollados, producidos, adquiridos de otro modo, conservados, transferidos o empleados, en su territorio o en cualquier otro lugar bajo su jurisdicción o control, para fines no prohibidos por la CAQ15.
Un componente básico del criterio de propósito general es el principio de coherencia. Una sustancia química tóxica en poder de un Estado Parte, de acuerdo con este principio de coherencia no solo debe ser producida, almacenada o utilizada para un propósito legítimo, sino que también lo debe ser del tipo y en la cantidad apropiados para ese propósito16.
La lista 2B.4. recoge todas aquellas sustancias químicas, excepto las sustancias enumeradas en la Lista 1, que contengan un átomo de fósforo al que esté enlazado un grupo metilo, etilo o propilo (normal o isopropilo), pero no otros átomos de carbono. La CAQ cita tan solo dos ejemplos, el dicloruro de metilfosfonilo (CAS 676-97-1) y el metilfosfonato de dimetilo (CAS 756-79-6), pero esta Lista 2B.4 es con mucho la que más sustancias químicas recoge (más de un millón de sustancias químicas).
Sólo hay una sustancia no recogida en la Lista 2B.4, y citada como excepción, que contiene un grupo etilo enlazado directamente al átomo de fósforo, pero no otros átomos de carbono, el Fonofos (etilfosfonotiolotionato de O-etilo y S-fenilo, con número CAS 944-22-9). Por supuesto los enantiómeros (S)P-Fonofos y (R)P-Fonofos tampoco están incluidos.
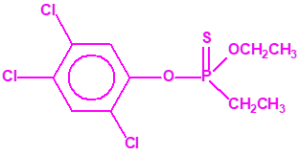
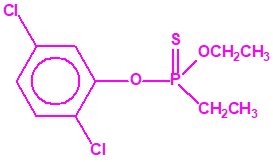
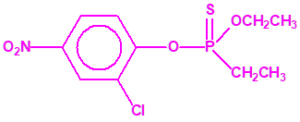
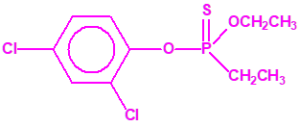
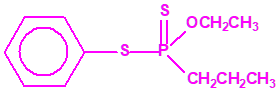
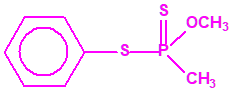
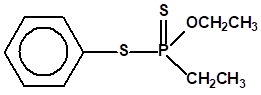
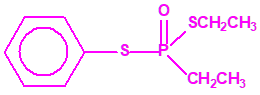
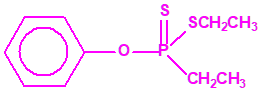
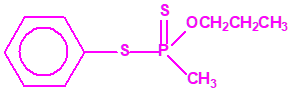
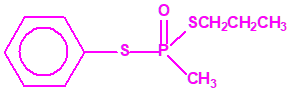
El fonofos tiene de fórmula empírica C10H15OPS2. Con esta misma fórmula empírica podemos encontrar muchas sustancias químicas recogidas en la Lista 2B.4, muchas de ellas con una estructura química muy parecida, incluso isómeros del propio fonofos, pero sólo el fonofos es una excepción en la Lista 2B.4:
Algunos isómeros con fórmula empírica C10H15OPS2:
 |
 |
 |
 |
 |
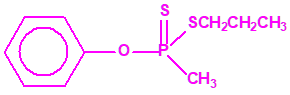 |
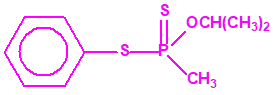 |
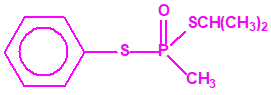 |
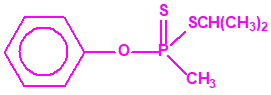 |
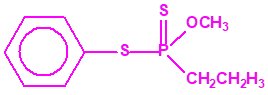 |
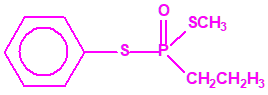 |
 |
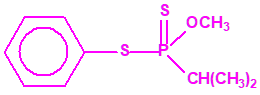 |
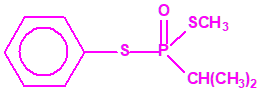 |
 |
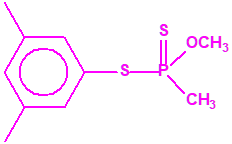
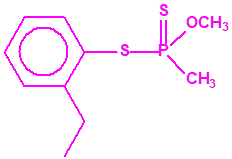
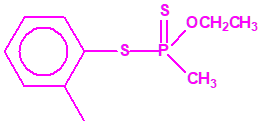
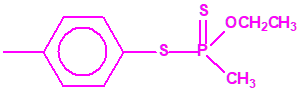
Si consideramos la presencia de cadenas alquílicas en el anillo bencénico, aparecen más isómeros, por ejemplo:
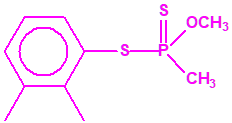 |
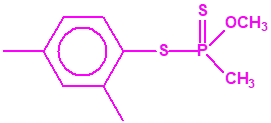 |
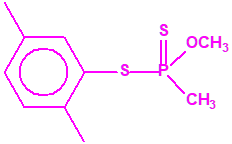 |
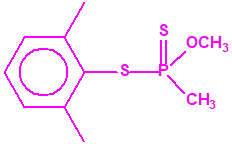 |
 |
 |
 |
 |
 |
 |
 |
 |
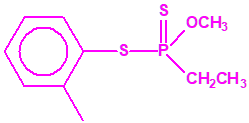 |
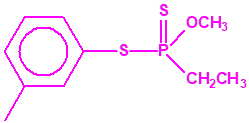 |
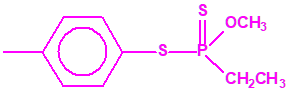 |
Otros pesticidas de estructura similar al fonofos, incluidos en la Lista 2B.4 por tener enlazado al átomo de fósforo un grupo metilo, etilo o propilo (normal o isopropilo), pero no otros átomos de carbono, son casi tan tóxicos o más que el fonofos, si comparamos su LD50 oral en ratas17:
|
Fonofos, Stauffer N-2790 CAS 944-22-9 |
16 mg/kg en rata |
|
Fonofos oxon, CAS 944-21-8 |
2,7 mg/kg en rata |
|
Tricloronato, Bayer 37289, CAS 327-98-0 |
15 mg/kg |
|
Stauffer N-3055, CAS 7260-35-7 |
19 mg/kg |
|
Stauffer N-2230, CAS 3563-52-8 |
23 mg/kg |
|
Stauffer N-3054, CAS 1593-27-7 |
25 mg/kg |
|
Stauffer N-2789, CAS 3099-88-5 |
43 mg/kg |
|
CAS 298471-6 |
55 mg/kg |
|
Stauffer N-3794, CAS 2984-70-5 |
90 mg/kg |
|
Stauffer N-3727, CAS 2984-68-1 |
141 mg/kg |
Recuerde que las estructuras mostradas en color magenta corresponden a sustancias incluidas en la Lista 2 de la CAQ, mientras que las mostradas en color negro no están incluidas en las Listas de la CAQ.
Conclusión
A la vista de los hechos todo indica que el Fonofos (Dyfonate) es un privilegiado por estar incluído (todavía) como una excepción en la Lista 2B.4 de la CAQ.
Referencias
- «Chapter 9: Fonofos», Regulatory Determinations Support Document for Selected Contaminants from the Second Drinking Water Contaminant Candidate List (CCL 2), EPA Report 815-R-08-012, https://www.epa.gov/sites/production/files/2014-09/documents/chapter_9_fonofos.pdf
- «Sittig’s handbook of pesticides and agricultural chemicals»-«Fonofos», Richard Pohanish, Elsevier, 2nd Ed., 2015
- «Sittig’s handbook of toxic and hazardous chemicals and carcinogens»- «Fonofos», Richard Pohanish, Elsevier, 7th Ed., 2017
- «MSDS Dyfonate», SPEX CertiPrep, https://www.spexcertiprep.com/MSDS/S-1815.pdf
- «Ficha de datos de seguridad Dyfonato», Merck, 2020, https://www.sigmaaldrich.com/MSDS/MSDS/DisplayMSDSPage.do?country=ES&language=es&productNumber=N11842&brand=SUPELCO&PageToGoToURL=https%3A%2F%2Fwww.sigmaaldrich.com%2Fcatalog%2Fsearch%3Fterm%3DN11842%26interface%3DAll%26N%3D0%26mode%3Dmatch%2520partialmax%26lang%3Des%26region%3DES%26focus%3Dproduct
- «The Dictionary of Substances and their Effects (DOSE): Din to H»-«Fonofos», Vol 4, 2ªEd., Mervyn Richardson & Sharat Gangolli, Royal Society of Chemistry
- «The pesticide manual», C. MacBean, BCPC 16th Edition, 2012
- «Chirality in synthetic agrochemicals: Bioactivity and safety consideration», IUPAC Reports on Pesticides (37), N. Kurihara, J. Miyamoto, G. D. Paulson, B. Zeeh, M. W. Skidmore, R. M. Hollingworth & H. A. Kuiper, Pure & Appl. Chem., Vol. 69, No. 9, 2007-2025,1997, http://publications.iupac.org/pac/1997/pdf/6906×1335.pdf
- «S-1815 Dyfonate», Safety Data Sheet – SPEX CertiPrep, https://www.google.es/url?sa=t&rct=j&q=&esrc=s&source=web&cd=&cad=rja&uact=8&ved=2ahUKEwjS06D5uabwAhWLmxQKHSgUDUgQFjAAegQIAxAD&url=https%3A%2F%2Fwww.spexcertiprep.com%2FMSDS%2FS-1815.pdf&usg=AOvVaw0d3BGGvtRZWm8m6r_cGbRW
- Patente US2988474, «Novel insecticides, acaricides and nematocides», Karoly Szabo, John G. Brady & Thomas B. Williamson, Stauffer Chemical Company, 1960, https://patentimages.storage.googleapis.com/4d/3a/2f/fe9be848e4135f/US2988474.pdf
- «Studies on the chiral isomers of Fonofos and Fonofos Oxon: I. Toxicity and antiesterase activities», Philip W. Lee, Reza Allahyari & T. Roy Fukuto, Pesticide biochemistry and physiology, 8, 146-157, (1978)
- «Chirality of organophosphorus pesticides: Analysis and toxicity», Mae Grace Nillos, Jay Gana & Daniel Schlenka, Journal of Chromatography B, 878 (2010) 1277-1284.
- «Studies on the Chiral Isomers of Fonofos and Fonofos Oxon: II. In Vitro Metabolism», Philip W. Lee, Reza Allahyari & T. Roy Fukuto, Pesticide Biochemistry and Physiology, 8, 158-169, (1978)
- «Convención sobre la Prohibición del Desarrollo, la Producción, el Almacenamiento y el Empleo de Armas Químicas y sobre su Destrucción», Organización para la Prohibición de las Armas Químicas (OPAQ), https://www.opcw.org/sites/default/files/documents/CWC/CWC_es.pdf
- «Implementation of the General Purpose Criterion of the Chemical Weapons Convention», Graham S. Pearson, January 2003, https://www.brad.ac.uk/acad/scwc/cwcrcp/cwcrcp_3.pdf
- «What is a Chemical Weapon?», Fact Sheet 4, OPCW, https://www.google.es/url?sa=t&rct=j&q=&esrc=s&source=web&cd=&ved=2ahUKEwif7KKqn6HwAhVUoVwKHTuNAYcQFjAOegQIExAD&url=https%3A%2F%2Fwww.acs.org%2Fcontent%2Fdam%2Facsorg%2Fevents%2Fprogram-in-a-box%2Fdocuments%2F2016-global-security%2Fcw-types.pdf&usg=AOvVaw3baZuSfHxQXJnERb0v-5tD
- «Organophosphorus pesticides: Organic and Biological Chemistry», Morifusa Eto, CRC Press, 1979