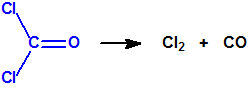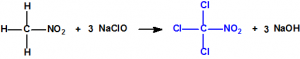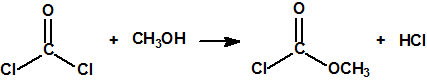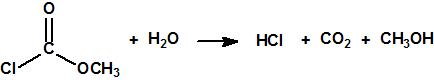La cloropicrina fue empleada por primera vez como agente químico de guerra por los rusos en agosto de 1916. La cloropicrina provoca importantes efectos sofocantes y lacrimógenos, y fue considerada durante la I Guerra Mundial como un agente lacrimógeno tóxico. Los alemanes, que marcaban los proyectiles de cloropicrina (a la que denominaban Klop) con una cruz verde (agentes sofocantes), empleaban también mezclas de cloro/cloropicrina (75/25) o de difosgeno/cloropicrina (65/35)1.
La cloropicrina poseia propiedades que la hacían muy útil como gas de guerra ofensivo, pues irritaba notablemente las vías respiratorias actuando como un gas sofocante, de manera similar al cloro y al fosgeno pero con un grado de toxicidad intermedio entre estos. También poseía un intenso poder lacrimógeno, aunque no tanto como los verdaderos agentes lacrimógenos de su época, como por el ejemplo en iodoacetato de etilo o SK. Además la cloropicrina tenía la peculiaridad de penetrar las mascaras alemanas en uso a principios de 19172.
Los ingleses y americanos utilizaban para la cloropicrina el acrónimo PS, y la utilizaban como tal o en mezclas. La mezcla «PG» era fosgeno/cloropicrina (entre 25/75 y 50/50) y la mezcla «NC» era cloropicrina/tetracloruro de estaño (80/20). Los franceses la denominaban «Acquinite» y utilizaban la mezcla cloropicrina/tetracloruro de estaño (75/25)1.
El nombre codificado de PS proviene de «Port Sunlight». Port Sunlight era una ciudad industrial inglesa, próxima a Liverpool, en el estuario del río Mersey, donde se encontraba la fábrica y los laboratorios de la empresa de jabón Lever Brothers (actualmente, Unilever) que además de fabricar los detergentes «Sunlight», se realizaron las investigaciones sobre la cloropicrina2.
La cloropicina tiene utilidad como como antimicrobiano de amplio espectro, fungicida, herbicida, insecticida y nematicida3, y también como indicador de peligro en algunas formulaciones de zyklon4,5,6,7. El zyklon C desarrollado por los alemanes era una variante del zyklon B (es decir, cianuro de hidrógeno adsorbido en un soporte) al cual se le añadía un 10 % de cloropicrina, que le confería un extraordinario poder irritante que advertía del peligro existente8.
La cloropicrina9,10,11,12,13
La cloropicrina es el tricloronitrometano, de fórmula empírica CCl3NO2 y peso molecular 164,38, que presenta una estructura tetraédrica:
La cloropicrina es conocida con diversos nombres o sinónimos: Acquinite, Chlor-O-Pic, Larvacide 100, Mycrolysin, Nitrochloroform, Pic-Chlor, Picfume, Picride, Profume A, PS (acrónimo militar), Trichlor, etc.
Su número CAS es 76-06-2, su número EC es 200-930-9 y su número ONU es UN1580. La cloropicrina está recogida en el anexo sobre sustancias químicas de la Convención para la Prohibición de las Armas Químicas como agente químico de Lista 3 (3A.4)14, pero no está recogida en la lista de control de las exportaciones de precursores de armas químicas (listas comunes de control del Grupo Australia).
Es un líquido incoloro de aspecto aceitoso y olor acre que provoca un intenso lacrimeo. Su umbral de olor es de tan solo 1,1 ppm. Su peso molecular es 164,38, tiene un punto de fusión de -69,2 °C y un punto de ebullición de 112,4 °C. Su densidad como líquido es 1,657 g/cm3 a 25 °C, y sus vapores son más densos que el aire, con una densidad relativa de 5,7. Ligeramente soluble en agua (0,162 g de cloropicrina en 100 mL de agua) su solubilidad disminuye al aumentar la temperatura. Es miscible en todas proporciones con alcohol absoluto, benceno, alcohol amílico y disulfuro de carbono. Además forma azeótropos con diversos alcoholes y con metilciclohexano:
| Mezcla azeotrópica (en %) | Puntos de ebulición | Punto de ebullición del azeótropo |
| Cloropricrina/etanol 35/65 | 112,4 °C/78,3 °C | 77,4 °C |
| Cloropricrina/isopropanol 33,5/66,5 | 112,4 °C/82,45 °C | 82,0 °C |
| Cloropricrina/propanol 58,5/41,5 | 112,4 °C/97,2 °C | 94,0 °C |
| Cloropricrina/isobutanol 67,5/32,5 | 112,4 °C/107,85 °C | 102,05 °C |
| Cloropricrina/metilciclohexano 29/71 | 112,4 °C/101,1 °C | 100,75 °C |
Para la cloropicrina el coeficiente de reparto Octanol /Agua expresado como Log Kow es de 52,09, indicando con ello que es posible su adsorción en tejidos grasos, suelos y sedimentos, y que por tanto es probable su bioconcentración o bioacumulación.
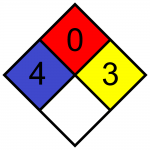
El rombo de identificación de peligro (basado en el sistema de clasificación NFPA-704 M) muestra un valor de 4 en salud, un valor de 0 en inflamabilidad y un valor de 3 en reactividad:
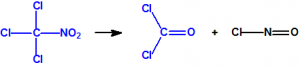
En su punto de ebullición la cloropicrina se descompone lentamente en cloruro de carbonilo, más conocido como fosgeno (CAS 75-44-5), y cloruro de nitrosilo (CAS 2696-92-6)
También se descompone bajo la acción de la luz ultravioleta, produciéndose primeramente cloruro de nitrosilo y fosgeno, pero luego éste último se descompone en monóxido de carbono y cloro:
Efectos de la cloropicrina
Exposición a la cloropicrina produce lagrimeo, irritación de la piel y edema pulmonar, pero el modo de acción no está completamente explicado. La cloropicrina parece que reacciona con los grupos sulfhidrilo de la hemoglobina poniendo en peligro el transporte de oxígeno15.
J.F. Mackworth demostró, en 1948, que los agentes lacrimógenos como el cloruro de fenacilo (CN), la bromoacetofenona (BA), el iodoacetato de etilo, la cloropicrina (PS) o el cianuro de bromobencilo inhibían fuertemente los grupos tiol de la enzima succinato deshidrogenasa (SDH) y del complejo de piruvato deshidrogenasa (PDH), que juegan un importante papel en las rutas metabólicas.16
Muchos efectos de la cloropicrina son consistentes con los efectos que producen los lacrimógenos (agentes de represión de disturbios) pero además produce importantes efectos en las vías aéreas superiores, motivo por el cual fue considerada durante la I Guerra Mundial como lacrimógeno tóxico, y fue posteriormente incluida como agente químico de Lista 3 de la CAQ. La cloropicrina NO es un agente de represión de disturbios por su carácter neumotóxico (sofocante), no está considerado como tal por la OPAQ y debe declararse como sustancia química de Lista 3.
La inhalación provoca dolor abdominal, tos, diarrea, vértigo, dolor de cabeza, náuseas, dolor de garganta, vómitos, debilidad, síntomas no inmediatos (véanse notas). No existen antídotos así que retire al afectado de la zona de exposición y póngale en una zona bien ventilada, en reposo y en posición de semiincorporada. Solicite asistencia médica.
En contacto con la piel produce enrojecimiento y dolor. Sobre los ojos produce enrojecimiento, dolor y visión borrosa. Retire las ropas contaminadas, aclare y lave la piel con agua abundante o mediante ducha, y enjuague los ojos con agua abundante durante varios minutos (quite las lentillas si es posible). Solicite asistencia médica. Si tiene que prestar ayuda procure utilizar protección respiratoria, protección ocular y guantes.
La ingestion es inusual, basta simplemente con que procure no comer, ni beber, ni fumar mientras trabaja en zonas donde exista exposición a la cloropicrina. En caso de ingestión enjuague la boca, beba abundante agua y solicite asistencia médica.
Los valores provisionales para los AEGLs (AEGL, Acute Emergency Guideline Level) son:
| Valores provisionales de los AEGL para la cloropicrina (en ppm) | |||||
| 10 min | 30 min | 60 min | 4 hr | 8 hr | |
| AEGL 1 | 0,050 | 0,050 | 0,050 | 0,050 | 0,050 |
| AEGL 2 | 0,15 | 0,15 | 0,15 | 0,15 | 0,15 |
| AEGL 3 | 2,0 | 2,0 | 1,4 | 0,79 | 0,58 |
El valor establecido por el NIOSH para el IDLH (National Institute for Occupational Safety and Health, Immediately Dangerous to Life or Health) es de 2 ppm y el valor establecido por la OSHA para el PEL (Occupational Safety and Health Administration, Permissible Exposure Limits) es de 0,1 ppm, como concentración promedio ponderada, TWA (Time-Weighted Average).
Los valores establecidos por la AIHA para los ERPG (American Industrial Hygiene Association, Emergency Response Planning Guidelines) son:
| ERPG-1: 0,1 ppm | ERPG-2: 0,3 ppm | ERPG-3: 1,5 ppm |
El factor de conversión (entre ppm y mg/m3) a una temperatura de 25 °C y una atmósfera de presión es de 1 ppm = 6,72 mg/m3. Recuerde que:
C(mg/m3) = C(ppm)×[masa molar (g)/volumen molar (L)]= C(ppm)×[ 164,38/24,465]= C(ppm)×[6,72]
Puesto que P×V=n×R×T, a una temperatura de 25 °C y una atmósfera de presión tenemos que V=0,082054×(273,16+25)=24,465 litros
En el agua de bebida la concentración máxima permisible es de 50 µg/L en función del sabor, y de 37 μg/L en función del olor17.
En caso de un accidente con cloropicrina, la «Guía de Respuesta en caso de Emergencia», GRE2016, aconseja el empleo de la Guía nº 154, «Sustancias – Tóxicas y/o Corrosivas (no combustibles)». Las distancias de aislamiento y de protección establecidas para los derrames de cloropicrina son las siguientes:
Obtención de la cloropicrina13,18
La cloropicrina fue descubierta en 1848 por el químico escocés, John Stenhouse, que la obtuvo al clorar el ácido pícrico, y de ahí que Stenhouse le asignase el nombre de «cloro-picrina», aunque hay que tener muy claro que el ácido pícrico y la cloropicrina son estructural y químicamente muy diferentes:
J. P. Orton y W. J. Pope obtuvieron, el 9 de mayo de 1918, la patente británica nº 142878 para la preparación de cloropicrina por la acción del cloro sobre el ácido pícrico o sobre otros nitroderivados apropiados de fenoles o naftoles, en presencia de agua y una sustancia alcalina, como hidróxidos o carbonatos de sodio o de potasio para disolver los nitroderivados y neutralizar el ácido producido en la reacción.
J. King obtuvo, el 13 de enero de1920, la pantente americana nº 1327714 sobre un proceso de producción de cloropicrina que consiste en formar una mezcla de hipoclorito cálcico (bleaching powder) con agua, que luego se añade sobre una solución de picrato cálcico.
J. P. Orton y P. V. McKie obtuvieron cloropicrina pasando cloro sobre una suspensión refrigerada de picrato sódico en una solución de carbonato sódico. El ácido pícrico se disuelve en una solución caliente de cuatro partes de carbonato sódico en cincuenta partes de agua. Esta pasta fina se enfria rápidamente por debajo de 5° C (para producir pequeños cristales), y luego se añade cloro, de manera lenta o intermitente (para evitar así la pérdida de cloro y la formación de cloratos). Además de cloropicrina se forma algo de ácido nítrico, también algo de cloruro e hipoclorito, y algo de clorato procedente de la desproporción o dismutación del hipoclorito:
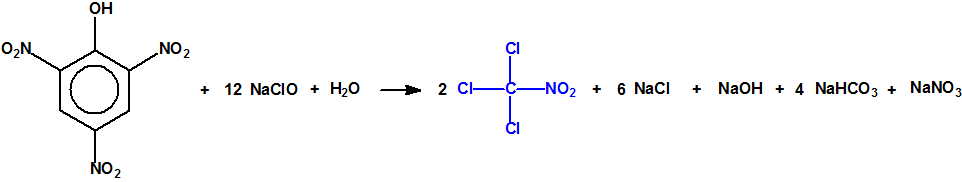
Sin embargo la cloropicrina suele fabricarse por cloración del nitrometano con hipoclorito de sodio:
Aplicaciones de la cloropicrina
Como ya se ha indicado, la cloropicrina se emplea como antimicrobiano de amplio espectro, fungicida, herbicida, insecticida y nematicida3.
La cloropicrina es un fumigante de amplio espectro que se difunde rápidamente través del suelo y es capaz de matar hongos, nemátodos, insectos y otras plagas que atacan las raíces.19
La cloropicrina no tiene propiedades herbicidas tan amplias como las del bromuro de metilo y del dietilditiocarbamato sódico (metam-sódico), ni propiedades nematicidas tan amplias como las del 1,3-dicloropropeno, por lo que se utiliza generalmente en combinación con estos. La cloropicrina tiene un umbral de olor muy bajo y causa irritación sensorial en concentraciones muy bajas, por lo que se ha agregado como un agente de advertencia frente a otros fumigantes como el bromuro de metilo y fluoruro de sulfurilo que son inodoros4,5,6,7,19.
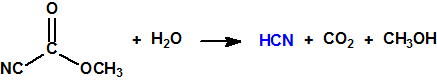
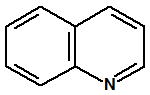
La cloropicrina se utiliza también en síntesis orgánica. Por ejemplo, J.A. Gardner y M. Williams obtuvieron el 13 de marzo de 1922, la patente inglesa nº 198462 para el empleo de cloropicrina como agente nitro-oxidante, en lugar de nitrobenceno, en la síntesis de la quinolina y sus derivados (reacción de Skraup o reacción de Dobner-Von Miller), que sirven, a su vez, para la preparación del azul de alizarina y de otros colorantes5,13.
 |
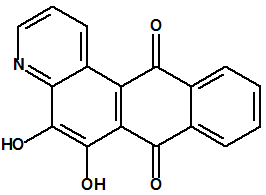 |
| Quinolina CAS 91-22-5 | Azul de alizarina CAS 568-02-5 |
L. Trumbull y W. L. Evans obtuvieron el 1 de marzo de 1922, la patente americana nº 1402195 para un proceso de fabricación del violeta cristal en el cual se utiliza la cloropicrina y la dimetilanilina5,13.
 |
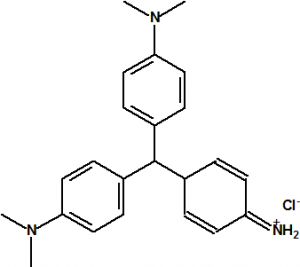 |
| N,N-dimetilanilina CAS 121-69-7 | Violeta cristal CAS 8004-87-3 |
Referencias
- «Armas quimicas, la ciencia en manos del mal», Rene Pita
- «GAS! -The Story of the Special Brigade», Major-General C. H. Foulkes, Andrews UK Limited, 2012
- «RED Fact Sheet: Chloropicrin». US Environmental Protection Agency, http://www.epa.gov/oppsrrd1/REDs/factsheets/chloropicrin-fs.pdf
- «Zyklon, ni héroe, ni planeta», cbrn.es, https://www.google.es/url?sa=t&rct=j&q=&esrc=s&source=web&cd=1&cad=rja&uact=8&ved=0ahUKEwj5y6HhvbzYAhWGRhQKHVHTAk8QFggnMAA&url=http%3A%2F%2Fcbrn.es%2F%3Fp%3D802&usg=AOvVaw1z2p9vuuOCbsZfPGNarIMO
- «Bibliography of chloropicrin, 1848-1932», R.C. Roark, U.S. Deparment of Agriculture, Miscellaneous publication nº176, February 1934
- «Admixture of irritants in hydrocyanic gas disinfection with especial reference to the use of chloropicrin as a danger indicator in zyklon C», T. Pohl & B. Tesch, Desinfektion 11: 88-90. 1926.
- «Experiments with certain fumigants used for the destruction of cockroaches», J. R. Ridlon, U.S. Public Health Reports, Vol. 46, No. 28, July 10, 1931. http://codoh.com/library/document/875/
- «Blausäuredurchgasungen zur Schädlingsbekämpfung», Von Otto Hecht, Die Naturwissenschaften, Volume 16, Issue 2, pp.17-23. 1928
- «6.3. Chloropicrin – PS», en «Compendium of Chemical Warfare Agents», Steven L. Hoenig, Springer, 2007
- «Chloropicrin (Agent PS)», Sittigs Handbook of Toxic and Hazardous Chemicals and Carcinogens, Richard P. Pohanish, 6ªEd, 2012
- «Cloropicrina, ficha de datos de seguridad», Sigma-Aldrich, https://www.sigmaaldrich.com/MSDS/MSDS/DisplayMSDSPage.do?country=ES&language=es&productNumber=34321&brand=SIAL&PageToGoToURL=https%3A%2F%2Fwww.sigmaaldrich.com%2Fcatalog%2Fproduct%2Fsial%2F34321%3Flang%3Des
- «Tricloronitrometano, Fichas Internacionales de Seguridad Química», INSHT, https://www.google.es/url?sa=t&rct=j&q=&esrc=s&source=web&cd=3&cad=rja&uact=8&ved=0ahUKEwjJ5oj_krzYAhWSKewKHcKUABsQFgg4MAI&url=http%3A%2F%2Fwww.insht.es%2FInshtWeb%2FContenidos%2FDocumentacion%2FFichasTecnicas%2FFISQ%2FFicheros%2F701a800%2Fnspn0750.pdf&usg=AOvVaw1bIqUoALPTJvuhnmd-_5u7
- «Chloropicrin», Kirby E. Jackson, Chem. Rev., 1934, 14 (2), pp 251–286
- «Convención sobre la Prohibición del Desarrollo, la Producción, el Almacenamiento y el Empleo de Armas Químicas y sobre su Destrucción», OPAQ, https://www.opcw.org/fileadmin/OPCW/CWC/CWC_es.pdf
- «Action of chloropicrin on hemoglobin», Claude Liebecq, Bull. Soc. Chim. Biol. 28:517, 1946, citado en «Chloropicrin Acute Exposure Guideline Levels (AEGLs)» , EPA, http://www.epadatadump.com/pdf-files-2014/chloropicrin_interim_0.pdf
- «The inhibition of thiol enzymes by lachrymators», J.F. Mackworth, Biochem. J., 42, 82-90, 1948, citado en «Handbook of Toxicology of Chemical Warfare Agents», Ramesh C. Gupta, 2ªEd
- US Environmental Protection Agency, National primary and secondary drinking water regulations, Fed. Regist. 54(97) (1989) 22062-22160
- «Nitro Compounds, Aliphatic» in Ullmann’s Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2005)
- «Evaluation of chloropicrin as a toxic air contaminant» http://www.cdpr.ca.gov/docs/emon/pubs/tac/part_b_0210.pdf