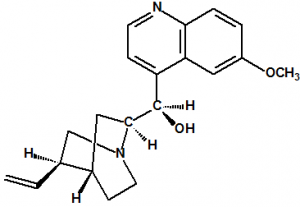
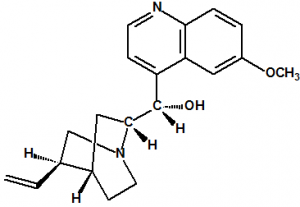
Isomería
Una de las características más llamativas de los compuestos orgánicos es la posibilidad de que presenten isomería.
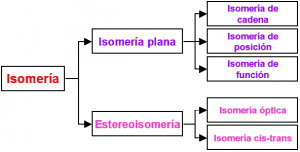
Dos compuestos con igual fórmula empírica o molecular, pero con pero distinta ordenación espacial de sus átomos, presentan propiedades físicas y/o químicas diferentes, y se dice que son isómeros.
Generalmente la palabra isómero se emplea para designar aquellos compuestos que están relacionados entre sí:
- por ser isómeros estructurales o de constitución, esto es, que tienen distinta ordenación o naturaleza en sus enlaces, o
- por ser isómeros de configuración o estereoisómeros, los cuales presentan distinta disposición tridimensional de los átomos.
Esquema con los distintos tipos de isomería
Estereoisomería
Los estereoisómeros se definen como isómeros que tienen la misma secuencia de átomos enlazados, pero con distinta orientación espacial. Se dividen en dos grandes grupos:
- Los que se originan por la distinta orientación espacial de átomos o grupo de átomos alrededor de un enlace doble y que se denominan isómeros geométricos.
- Los que se originan por la distinta orientación espacial de átomos o grupos de átomos alrededor de un centro asimétrico (generalmente un átomo de carbono tetraédrico con hibridación sp3, pero también un átomo de fósforo pentavalente). Estos estereoisómeros pueden ser a su vez:
- Enantiómeros que se relacionan entre sí por ser imágenes especulares no superponibles.
- Diastereoisómeros o diasterómeros, isómeros configuracionales que no son imagen especular uno del otro.
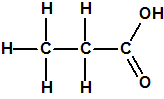
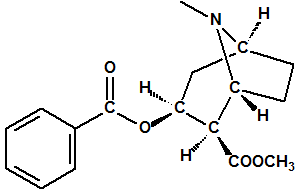
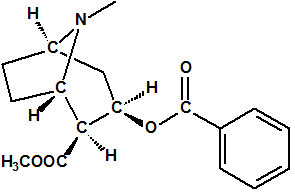
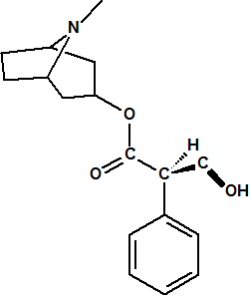
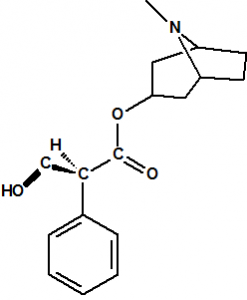
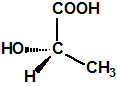
El término estereoquímica, del griego “stereos” que significa sólido, se aplica al estudio de la estructura tridimensional de las moléculas, esto es, de la disposición espacial de los átomos que la forman, así como a la parte relativa al comportamiento químico consecuencia de esa disposición espacial. Por ejemplo, el ácido láctico procedente de la leche agria tiene de fórmula molecular C3H6O3, exactamente igual que el ácido láctico producido en los músculos. Al estudiar la constitución química del ácido láctico, es decir al determinar cómo están enlazados los átomos, encontramos que el ácido láctico puede representarse con la fórmula molecular:
Sin embargo la información que obtenemos de esta fórmula todavía es incompleta, pues resulta que el ácido láctico que se encuentra en la leche agria es ligeramente diferente del ácido láctico que se produce en los músculos. Ambos presentan el mismo punto de fusión, presión de vapor, densidad, índice de refracción, espectro de masas, etc., pero sin embargo se comportan de manera distinta frente a la luz polarizada, uno de ellos, el muscular, hace rotar el plano de polarización en el sentido de las agujas del reloj (dextro-rotación), es el ácido (+)-láctico, y el otro, el de la leche, hace rotar el plano de polarización en el sentido contrario de las agujas del reloj (levo-rotación), es el ácido (-)-láctico. La diferencia entre estos dos ácidos lácticos es más significativa en su comportamiento bioquímico, pues en presencia de la enzima deshidrogenasa del ácido láctico, el ácido (-)-láctico, procedente de la fermentación de la leche queda inalterado, mientras que el ácido (+)-láctico es deshidrogenado a ácido pirúvico.
 |
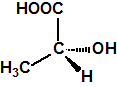 |
| ácido (+)-láctico | ácido (-)-láctico |
Esta diferenciación bioquímica entre formas dextro (+) y formas levo (-) es extraordinariamente significativa e importante en numerosos procesos naturales, y en consecuencia de gran interés desde el punto de vista práctico e industrial. La toxicidad de muchas sustancias químicas también varía significativamente entre los diferentes estereoisómeros, de ahí el interés desde el punto de vista NBQ.
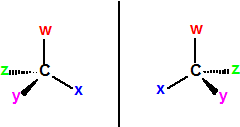
Este fenómeno consiguió explicarse cuando los químicos comenzaron a considerar la disposición tridimensional de las moléculas en el espacio y la configuración tetraédrica del átomo de carbono. Las propiedades geométricas de un carbono con hibridación sp3 hacen que, en el caso de que esté unido a cuatro átomos o grupos de átomos diferentes, la molécula no tenga plano de simetría y que existan dos maneras diferentes de ordenar a los cuatro átomos o grupos de átomos. Estas dos ordenaciones o configuraciones generan dos formas isoméricas denominadas enantiómeros, que son imágenes especulares entre sí pero que no son superponibles.
Cuando esto ocurre se dice que la molécula es quiral y óptimamente activa, puesto que es capaz de desviar el plano de la luz polarizada. Dos enantiómeros desvían el plano de la luz polarizada en la misma magnitud pero en sentidos opuestos.
Al carbono con hibridación sp3 que está unido a cuatro átomos o grupos de átomos diferentes se le denomina estereocentro. En la siguiente figura se muestra la disposición tetraédrica de un átomo de carbono con hibridación sp3 unido a cuatro grupos diferentes y su imagen especular no superponible:
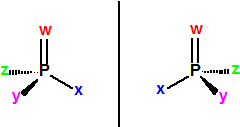
La quiralidad no es una propiedad exclusiva de las moléculas orgánicas con átomos de carbono asimétricos. Por ejemplo, el átomo de fósforo también puede presentar isómeros ópticos:
Nomenclatura de los isómeros configuracionales
El sistema más aceptado para nombrar esteroisómeros es la denominada convención de Cahn, Ingold y Prelog, que asigna una letra R o S a cada centro estereogénico de una molécula quiral.
Las reglas (resumidas) que hay que seguir para asignar una configuración R o S son las siguientes:
- A cada átomo o grupo químico unido al centro asimétrico se le asigna una prioridad según el número atómico; el átomo de mayor prioridad es el de mayor número atómico.
- Una vez asignado el orden de prioridad se mira el centro asimétrico desde el lado opuesto al grupo de menor prioridad.
- Si el orden de prioridades decreciente de los restantes grupos representa una secuencia en el sentido de las agujas del reloj se asigna al estereocentro la configuración R (rectus, derecha), y si la secuencia es en el sentido contrario de las agujas del reloj se asigna al estereocentro la configuración S.
Toxicidad
Los científicos se percataron muy pronto de la importancia fisiológica y toxicológica de los compuestos quirales. En los años 1890-1894, E. Poulson y P. Ehrlich y A. Einhorn ya observaron que la dextro-cocaína poseía mayor actividad, actuaba más rápidamente y su efecto era menos duradero que el de la levo-cocaína.
A principios del siglo XX, en 1903, A. R. Cushny observó que la atropina (hiosciamina racémica) y la levo-hiosciamina presentaban diferencias en su actividad pupilar, cardiaca y salival y en los efectos reflejos de la médula espinal.
En 1904, A. Pictet y A. Rotschy observaron diferencias en la toxicidad de los isómeros de la nicotina y en 1910, W. E. Grove observó esto mismo en los isómeros del alcanfor.
Explorando compuestos endógenos, E. Abderhalden y F. Müller, (1908) describieron, en 1908, los efectos vasopresores significativamente distintos de los isómeros dextro- y levo- de la adrenalina o epinefrina. En 1918, W. Frey informaba de las diferencias terapeúticas en el tratamiento de arritmias entre la quinina y su isómero la quinidina, resultando está última más efectiva.
Muchos contaminantes ambientales son quirales, incluyendo sustancias organofosforadas y organocloradas, piretroides, bifenilos policlorados (PCB), policloro dibenzo-p-dioxinas (PCDD) y policloro dibenzofuranos (PCDF), fipronilo y contaminantes farmacéuticos. La degradación de estos compuestos, así como su bioacumulación, persistencia y toxicidad, muestran a menudo una dependencia de tipo quiral.
La estéreo especificidad que muestran algunos insecticidas organofosforados se extiende también a los agentes neurotóxicos de guerra.
Los compuestos de fósforo pentavalente presentan cuatro enlaces dispuestos de manera tetraédrica al igual que los compuestos de carbono tetraédrico y por ello son posibles formas ópticamente activas con el átomo de fósforo como centro asimétrico. El primer compuesto con enantiómeros debidos al fósforo, el óxido de etilfenilmetilfosfina, fue aislado en 1911 por J. Meisenheimer.
Muchos plaguicidas organofosforados tienen un átomo de fósforo asimétrico y varios se han resuelto en enantiomeros individuales. Aunque los enantiómeros tienen propiedades idénticas, excepto su capacidad de girar un plano de luz polarizada en direcciones opuestas, sus actividades biológicas dependen grandemente de su quiralidad. Esto es debido a que las moléculas biológicas son quirales y discriminan entre los enantiómeros. Desde hace años se viene trabajando mucho en el aislamiento y examen de la actividad biológica de los enantiómeros de los compuestos organofosforados, tratando de entender el papel de la quiralidad en la determinación de la toxicidad de los agentes neurotóxicos de guerra.
Las constantes de velocidad de inhibición de la acetilcolinesterasa (AChE) y la toxicidad suele ser mayor en los enantiómeros levo que en los dextro.
H. P. Benschop y L.P.A. De Jong han demostrado la diferente inhibición de la acetilcolinesterasa por parte de los diferentes esteroisómeros de algunos agentes neurotóxicos de guerra: tabun, sarin, VX y soman (este último con dos centros quirales, uno debido al átomo de fósforo y otro debido a un átomo de carbono).
Así, por ejemplo, en el caso del somán (GD), los isómeros P(−) son casi los únicos responsables de la toxicidad del compuesto. Para el sarín (GB), el isómero P(−) es aproximadamente dos veces más tóxico que el sarín racémico, lo que indica que la toxicidad del sarín se debe esencialmente al isómero P(−). Para el VX, el isómero P(−) es aproximadamente 13 veces más tóxico que el isómero P(+), mientras que el isómero P(-) del tabún (GA) es aproximadamente siete veces más tóxico que el isómero P(+).
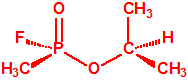 |
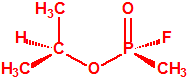 |
| (R)-(-)-sarin, CAS 6171-94-4 | (S)-(+)-sarin, CAS 6171-93-3 |
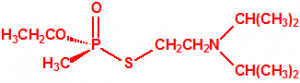 |
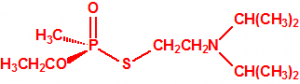 |
| (S)- VX, (S)- S-[2-(diisopropilamino) etil] metilfosfonotiolato de O-etilo, CAS 65167-64-8 | (R)-VX, (R)- S-[2-(diisopropilamino) etil] metilfosfonotiolato de O-etilo, CAS 65167-63-7 |
A continuación se muestran las estructuras químicas de los cuatro estereoisómeros de soman. Se ha demostrado que los dos diastereoisómeros de soman que poseen en el átomo de fósforo la configuración «S» (SP) son considerablemente más tóxicos que los otros dos diastereoisómeros que poseen en el átomo de fósforo la configuración «R» (RP)
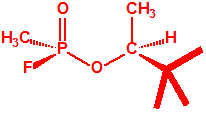 |
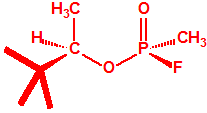 |
| SPSC -Somán, CAS 24753-16-0 |
RPRC-Somán, CAS 22956-47-4 |
 |
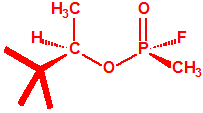 |
| RPSC-Somán, CAS 24753-15-9 |
SPRC-Somán, CAS 22956-48-5 |
Referencias
- Elementos de estereoquímica, Ernest L. Eliel, Editorial Limusa, 1975
- Reglas de Cahn-Ingold-Prelog, https://es.wikipedia.org/wiki/Reglas_de_Cahn-Ingold-Prelog
- Nomenclatura de la química orgánica (IUPAC), Secciones A, B, C, D, E, F y H, Consejo Superior de Investigaciones Científicas, 1987, Sección E: Estereoquímica
- Chiral toxicology: It´s the same thing…only different, Silas W. Smith, Toxicological Sciences 110(1), 4-30 (2009)
- Best Synthetic Methods-Organophosphorus (V) Chemistry, Chapter 1, General Overview, Christopher M. Timperley, Academic Press-Elsevier, 2015
- Isolation, anticholinesterase properties, and acute toxicity in mice of four stereoisomers of the nerve agent soman, Benschop, H. P.; Konings, C. A. G.; Genderen, J. V.; De Jong, L. P. A. Toxicol. Pharmacol LIQ. 1984, 72, 61-74.
- Stereospecificity in the enzymatic hydrolysis of cyclosarin (GF), Steven P. Harvey, Jan E. Kolakowski, Tu-Chen Cheng, and others, http://www.chem.tamu.edu/rgroup/raushel/publications/P205-EnzyMicrobTech-Phosphotriesterase-2005.pdf