La hexamina (CAS 100-97-0), también conocida como hexametilentetramina, urotropina, metenamina, formamina, HMTA, HMT, hexaformo, 1,3,5,7-tetraazaadamantano, etc., no es una amina cualquiera.
Las aminas son derivados orgánicos del amoníaco, en los que uno, dos o tres de los átomos de hidrógeno han sido sustituidos por radicales orgánicos, dando lugar, respectivamente, a las aminas primarias, secundarias y terciarias. El amoníaco y las aminas son bases de Lewis, pues son capaces de compartir el par de electrones solitarios del átomo de nitrógeno. El amoníaco y las aminas son bases de Bronsted por su capacidad de combinarse con los protones1,2.
Las aminas son por lo general bases más fuertes que el agua, los alcoholes o los éteres3. La reacción alcalina observada cuando se disuelve una amina en agua se debe al equilibrio:
R3N: + H2O ⇔ R3NH+ + HO–
Kb = [R3NH+]×[HO–]/[R3N:]
pKb = – log Kb
Los valores de pKb no suelen utilizarse, de modo que la basicidad de las aminas suele medirse en términos del valor de su pKa de su ácido conjugado, sabiendo que pKb + pKa = 14.
R3NH+ + H2O ⇔ H3O+ + R3N:
La base conjugada de un ácido débil es una base fuerte y cuanto mayor es el pKa, más débil es el ácido, R3NH+, y más fuerte la base conjugada, R3N:. La base conjugada de un ácido fuerte es una base débil y cuanto más pequeño es el pKa, más fuerte es el ácido, R3NH+, y más débil la base conjugada, R3N:.
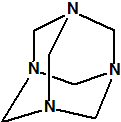
La hexamina
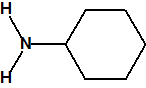
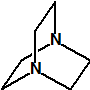
La hexamina (CAS 100-97-0) es una amina cíclica que nada tiene que ver con la hexilamina (CAS 111-26-2), ni con la ciclohexilamina (CAS 108-91-8). Se asemeja en parte a la trietilendiamina (C6H12N2, CAS 280-57-9, también conocida como TEDA, 1,4-diazabiciclo[2.2.2]octano o DABCO), que también tiene una estructura de caja muy simétrica.
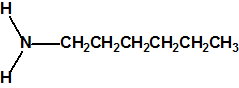 |
 |
 |
 |
| hexilamina
(CAS 111-26-2) |
ciclohexilamina
(CAS 108-91-8) |
trietilendiamina
(CAS 280-57-9) |
hexamina
(CAS 100-97-0) |
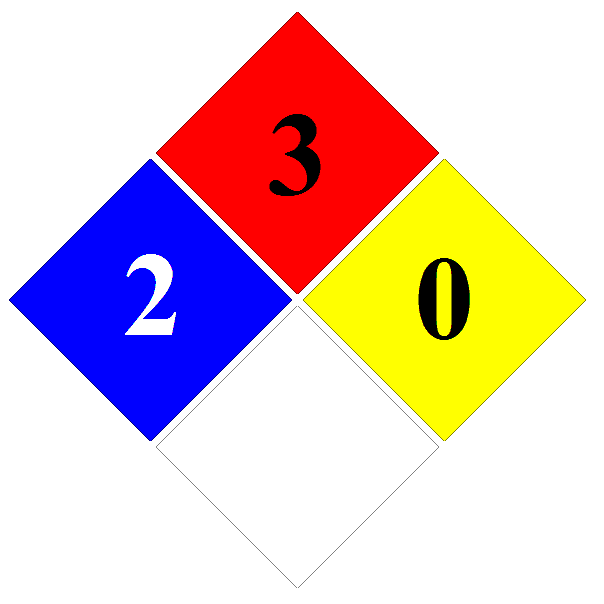
Según la nomenclatura IUPAC la hexamina es el 1,3,5,7-tetraazatriciclo[3.3.1.13,7]decano4, con fórmula empírica C6H12N4 y peso molecular 140,19. Es un polvo blanco, cristalino, que a presión reducida (2 kPa) sublima a 230-270 °C sin descomposición. Su número ONU es el 1328 y su número EINECS es el 202-905-8. Su principal peligro según el rombo de la NFPA es su inflamabilidad(3):
La hexamina es fácilmente soluble en agua, a 12 °C, 81,3 g de hexamina se disuelven en 100 g de agua; la solubilidad disminuye ligeramente con el aumento de temperatura. La solubilidad en otros disolventes es menor, 13,4 g en cloroformo, 7,25 g en metanol, 2,89 g en etanol absoluto, 0,65 g en acetona, 0,23 g en benceno, 0,14 g en xileno, 0,06 g en éter etílico y prácticamente insoluble en éter de petróleo (a 20 °C para 100 g de disolvente). A partir de de etanol cristaliza como cristales rombododecaédricos incoloros e higroscópicos. Tiene una densidad de 1,3394 g/cm3, a 22 °C, y punto de inflamación de 250 °C. Consulte las diferentes fichas de datos de seguridad (FDS), en inglés Material Safety Data Sheet (MSDS), para conocer las particularidades y propiedades de la hexamina para un adecuado uso de la misma.5,6,7
La hexamina da reacción monobásica con casi todos los ácidos, pero frente a los acidos fuertes se comporta como dibásica.
¡El número de átomos de nitrógeno no guarda relación con la reacción básica!
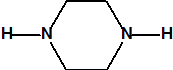
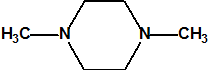
La piperacina, (C4H10N2, CAS 110-85-0), tiene dos átomos de nitrógeno y un pKa=9,8, la N,N-dimetilpiperacina, (C6H14N2, CAS 106-58-1), tiene dos átomos de nitrógeno y un pKa=5,74. La trietilendiamina, TEDA, (C6H12N2, CAS 280-57-9) tiene dos átomos de nitrógeno y dos pKa (pKa1=2,95 y pKa2=8,60). La hexamina, (C6H12N4, CAS 100-97-0), tiene cuatro átomos de nitrógeno y un pKa=8,4. Recordemos que el amoníaco tiene un pKa=9,25 y la metilamina un pKa=10,63
 |
 |
 |
 |
| piperacina
(CAS 110-85-0) pKa=9,8 |
N,N-dimetilpiperacina
(CAS 106-58-1) pKa=5,74 |
trietilendiamina
(CAS 280-57-9) pKa1=2,95 y pKa2=8,60 |
hexamina
(CAS 100-97-0) pKa=8,4 |
No parece sostenerse la afirmación de que que la hexamina (hexametilentetramina), por el simple hecho de que su nombre contenga el término «tetramina» pueda comportarse como tetrabásica y sea capaz de fijar cuatro moléculas de ácido fluorhídrico2:
«Upon further examination, hexamine is not a bad candidate for use in laboratory or factory acid reduction, as it is rather efficient, with one molecule of hexamine capable of binding up to four molecules of HF.»
¡La hexamina no da reacción tetrabásica!
La hexamina fue sintetizada y caracterizada por el químico ruso Alexander Mikhaylovich Butlerov en 18598. Butlerov también descubrió en 1861 la reacción de la formosa9, que supone la formación de azúcares a partir del formaldehído. La palabra «formosa» es una contracción de formaldehído y aldosa. La hexamina también fue el primer compuesto orgánico con una estructura cristalina resuelta mediante rayos X.
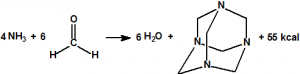
La hexamina o hexametilentetramina (HMT) es un producto de condensación que se forma fácilmente a partir de amoníaco y formaldehído gaseosos o de disoluciones acuosas u orgánicas de éstos8. La condensación de cuatro moléculas de amoníaco con seis moléculas de formaldehido produce una molécula de hexamina en una reacción bastante exotérmica (se liberan 55 kcal/mol). El carácter exotérmico se debe a la transformación del enlace p en enlace s en el carbono del formaldehido:
Se obtiene comercialmente haciendo pasar amoníaco gaseoso en una solución acuosa concentrada de formaldehido, con posterior eliminación del agua a presión reducida. A pequeña escala la hexamina puede obtenerse más fácilmente haciendo pasar amoniaco gaseoso en una solución de paraformaldehído en tolueno a reflujo, con eliminación de agua formada (por ejemplo, con una trampa de Dean-Stark).
Despues de mantener irradiada con luz ultavioleta, a temperatura ambiente, durante 45 días, una mezcla de metanol, amoníaco y agua, el principal producto obtenido (aproximadamente un 35%) resulta ser hexamina.
La hexamina es estable en medio acuoso neutro y básico, pero sin embargo en medio ácido es hidrolizada a metanimina (H2C=NH, CAS 2053-29-4), formaldehído y amoníaco:
C6H12N4 + 4 H2O → 2 H2C=NH + 4 CH2O + 2 NH3
La termólisis o descomposición térmica de hexamina produce fundamentalmente amoníaco, cianuro de hidrógeno, metano, nitrógeno e hidrógeno. A 800 °C se produce un 73 % de ácido cianhídrico y a 1200 °C, un 92 %.
Usos
La hexamina ya sea en forma de polvo granular o en forma de solución al 42.5%, en tambores o en bolsas, en vagones o en camiones, tiene múltiples aplicaciones en multiples industrias.10,11,12,13,14
Sintéticamente, la hexamina es útil en la alquilación de aminas primarias (reacción de Delepine):
C6H12N4 + R-CH2-X → [C6H12N4-CH2-R]+ X–
[C6H12N4-CH2-R]+ X– + 3 HX + 6 H2O → [NH3-CH2-R]+X– + 6 CH2O + 3 NH4X
y en la generación de amino alcoholes por reacción con oxiranes:
C6H12N4 + R-C2H3O + 3 HX + 6 H2O → R-CH(OH)-CH2(NH2) + 6 CH2O + 3 NH4X
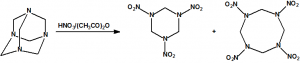
La nitración de la hexamina permite la obtención del hexógeno (CAS 121-82-4), también conocido como ciclonita, ciclotrimetilentrinitramina o RDX y del octógeno (CAS 2691-41-0), también conocido como ciclotetrametilentetranitramina o HMX:
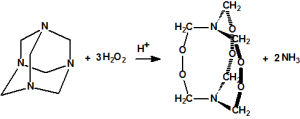
La hexamina reacciona con peróxido de hidrógeno en presencia de ácido cítrico o de ácido sulfúrico como catalizadores para producir 3,4,8,9,12,13-hexaoxa-1,6-diazabiciclo[4.4.4]tetradecano (HMTD, HexaMethylene Triperoxide Diamine), CAS 283-66-9, un explosivo casero utilizado en algunos artefactos explosivos improvisados, pero extremadamente peligroso por su elevada sensibilidad al choque, a la fricción, al calor, a las chispas y a las descargas electrostáticas:
La hexamina constituye también el ingrediente principal de las pastillas de combustible sólido tan empleadas a nivel civil como a nivel militar. Las pastillas de hexamina no son explosivas, prenden con facilidad con cerillas o mecheros, arden sin apenas humo, no funden mientras arden, apenas dejan cenizas y tienen una elevada potencia calorífica (4200kJ/mol, esto es, 1003kcal/mol, o lo que es lo mismo, unas 4818 kcal/kg).
La hexamina también se emplea en la producción de resinas fenólicas y resinas de urea-formaldehido. Se emplea como catalizador en los polvos de moldeo de baquelita (fenol-formaldehído).
En la industria del caucho se emplea como agente de vulcanizado actuando como un acelerante secundario que actua sobre otros acelerantes de tipo mercapto y sulfenamida. La dinitrosopentametilentetramina, DNPT, (3,7-dinitroso-1,3,5,7-tetrazabiciclo[3.3.1]nonano, CAS 101-25-7, se emplea como agente insuflante o espumante para el caucho natural y sintético.
Fertilizantes de urea. La hexamina se emplea como donador de formaldehido para el recubrimiento de los gránulos de urea para mejorar su fluidez.
La hexamina no es biocida por sí misma, pero libera en medio ácido formaldehído que sí tiene un fuerte efecto antisptico. Como tal, se utiliza como ingrediente en desodorantes de aplicación externa. Con el nombre de metenamina o Urotropin®, se utiliza como desinfectante para las vías urinarias.
La adición de hexamina como inhibidor de corrosión a las soluciones de decapado ha demostrado ser eficaz para la prevención la corrosión de los componentes de hierro y de acero durante el decapado con ácidos minerales.
En la industria textil la hexamina se utiliza como agente antiencogimiento para en combinación con otros productos obtener acabados resistentes y mejorar la velocidad de teñido.
En la fabricación de espumas de poliuretano y de caucho se utiliza además de otras sustancias, dinitrosopentametilentetramina (DNPT) como agente espumante. Esta DNPT se prepara a partir de hexamina y nitrito sódico en una solución de ácido acético, y genera una espuma con una estructura porosa muy fina y uniforme.
En la fabricación de aglomerado de madera se añade hexamina al pegamento empleado durante el proceso de prensado para evitar el olor a amoníaco y conseguir un endurecimiento uniforme, sobre todo en la cara superior e inferior del tablero de aglomerado.
Conclusiones
- La hexamina es una sustancia que no está recogida ni en las listas de la CAQ, ni en el Grupo Australia. Tampoco está recogida en el Reglamento de control del comercio exterior de material de defensa, de otro material y de productos y tecnologías de doble uso.
- La hexamina tiene muchos usos y aplicaciones conocidos (), pero no se sabe de su aplicación como agente neutralizante del ácido fluorhídrico en la síntesis del sarín.
- La hexamina tiene un pKa=8,6 mucho más pequeño que la isopropilamina (pKa=10,63), la trietilamina (pKa=10,78) o la tributilamina (pKa=10,89), es decir tiene un menor carácter básico que éstas.
- La hexamina a pesar de tener cuatro átomos de nitrógeno se comporta como sustancia monobásica, y sólo se comporta como dibásica con los ácidos fuertes. No parece que una molécula de hexamina sea capaz de fijar cuatro moléculas de ácido fluorhídrico.
- La hexamina tiene un precio muy superior al de las aminas alifáticas corrientes (por ejemplo es del orden de cuatro veces más cara que la isopropilamina)
- La hexamina es un sólido mientras que las aminas alifáticas citadas anteriormente son líquidas, aunque se disuelve bien en agua y en disolventes orgánicos polares
- La hexamina es una sustancia al alcance de cualquiera, y su presencia en una muestra no implica que sea del gobierno sirio, por el simple hecho de que éste declarara la posesión de 80 tm (no se sabe con qué finalidad, pues también declaró 30 tm de trietilamina y 40 tm de isopropilamina, ninguna de las dos recogida ni en las listas de la CAQ, ni en el Grupo Australia).
Referencias
- «Química orgánica superior», L.F.Fieser&M.Fieser, Ediciones Grigalbo,1966.
- «Amines and Sarin – Hexamine, Isopropylamine, and the Rest…», Dan Kaszeta, 2014, https://www.bellingcat.com/news/mena/2014/08/05/amines-and-sarin-hexamine-isopropylamine-and-the-rest/
- «Chapter 24-Amines», http://as.vanderbilt.edu/chemistry/Rizzo/Chem220b/Chapter_24.pdf
- «Amines aliphatic», Ullmann’s Encyclopedia of Industrial Chemistry, 7th ed
- «Hexamethylenetetramine MSDS», Santa Cruz Biotechnology Inc., http://datasheets.scbt.com/sds/AGHS/EN/sc-211588.pdf
- «Hexamina FDS», New Jersey Department of Health, http://nj.gov/health/eoh/rtkweb/documents/fs/0996sp.pdf
- «Hexametilentetramina, FDS», Sigma-Aldrich, http://www.sigmaaldrich.com/MSDS/MSDS/DisplayMSDSPage.do?country=ES&language=es&productNumber=33233&brand=SIAL&PageToGoToURL=http%3A%2F%2Fwww.sigmaaldrich.com%2Fcatalog%2Fproduct%2Fsial%2F33233%3Flang%3Des
- «Hexamethylentetramine», Encyclopedia of Astrobiology, R. Amils, J.Cernicharo, H.J. Cleaves II, W.M. Irvine, D.L. Pinti & M. Viso, pag. 756, Springer-Verlag, 2011.
- «Formose reation», Encyclopedia of Astrobiology, R. Amils, J.Cernicharo, H.J. Cleaves II, W.M. Irvine, D.L. Pinti & M. Viso, pags. 600-605, Springer-Verlag, 2011
- «Hexamethylenetetramine-A Versatile Reagent in Organic Synthesis», N. Blacevic, D. Kolbah, B. Belin, V. Sunjic & F. Kajfez, https://www.google.es/url?sa=t&rct=j&q=&esrc=s&source=web&cd=9&ved=0ahUKEwi67Jf5mcPMAhUEIcAKHZy_AKsQFgh2MAg&url=https%3A%2F%2Fwww.researchgate.net%2Ffile.PostFileLoader.html%3Fid%3D55c7105e5cd9e376818b45b3%26assetKey%3DAS%253A273828125577240%25401442297120639&usg=AFQjCNFxNtmn2a3rRN4f7dJd1I0KnRaPsw
- «Synthetic Nitrogen Products A Practical Guide to the Products and Processes», Gary R. Maxwell, Kluwer Academic/Plenum Publishers, 2004
- «Hexamine-A Techno-Commercial Profile», http://www.chemicalweekly.com/Profiles/Hexamine.pdf
- «Hexamethylenetetramine», The MAK Collection for Occupational Health and Safety, http://onlinelibrary.wiley.com/doi/10.1002/3527600418.mb10097kske0005/pdf
- «Hexamine», Riegel’s Handbook of Industrial Chemistry, James A. Kent, Springer, 1992