El maloliente sulfuro de hidrógeno está de moda, esta vez por su posible uso terrorista mediante un dispositivo químico improvisado (IQD)1,2,3. La última vez que objeto de interés fue en el año 2008 cuando en Japón hubo una oleada de suicidios empleando sulfuro de hidrógeno de fabricación casera4. A pesar de su toxicidad y de sus posible usos con fines terroristas o suicidas, el sulfuro de hidrógeno y sus derivados forman un importante papel para la vida.
El sulfuro de hidrógeno5,6,7,8,9
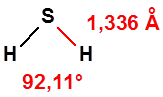
El sulfuro de hidrógeno, también conocido como ácido sulfhídrico, con número CAS 7783-06-4, es una molécula pequeña, de fórmula empírica, H2S, y estructura angular:
Tiene un peso molecular de 34,08, con punto de fusión -85 °C y punto de ebullición -60 °C. Es un gas, de densidad relativa 1,19, es decir, es algo más denso que el aire, incoloro, y con un característico olor a huevos podridos.
Es un gas extremadamente inflamable y sus mezclas con aire son explosivas (límite inferior de inflamabilidad 4,3 % v/v, y límite superior de inflamabilidad del 46 % v/v).
El sulfuro de hidrógeno es bastante soluble en agua (a 20 °C se disuelve 1 g en 242 ml de agua) y la disolución acuosa tiene propiedades ligeramente ácidas debido a formación de ácido sulfhídrico, un ácido débil, dibásico con constantes de disociación pKa1= 7,0 y pKa2= 13,9.
El sulfuro de hidrógeno se comporta como reductor, tanto en forma gaseosa, como en disolución acuosa, oxidándose lentamente en presencia del oxígeno del aire. Los potenciales redox estándar del sulfuro de hidrógeno a 25 °C son8:
H2S ⇔ S + 2 H+ + 2 e– E0 = 0,142 – 0,0591 pH – 0,0295 log(H2S)
HS– ⇔ S + H+ + 2 e– E0 = -0,065 – 0,0295 pH – 0,0295 log(HS–)
S2- ⇔ S + 2 e– E0 = -0,476 – 0,0295 log(S2-)
Sulfuro de hidrógeno se libera como gas en los volcanes, manantiales de azufre, pantanos, masas de agua estancada, petróleo crudo, gas natural y pozos de carbón o estiércol. También es liberado por las bacterias, hongos y actinomicetos durante la descomposición de las proteínas que contienen azufre y por reducción directa del sulfato. En la desulfuración de las fracciones de destilado de gasoil y coque en presencia de hidrógeno, también se produce sulfuro de hidrógeno
Por otro lado se puede producir el sulfuro de hidrógeno en la boca y en el tracto intestinal por el metabolismo bacteriano de los aminoácidos que contienen grupos SH y el sulfuro de hidrógeno endógeno juega un importante papel en algunos procesos neurológicos y fisiológicos.
Sulfuro de hidrógeno se utiliza en la producción de ácido sulfúrico y azufre elemental, en la preparación de sulfuros inorgánicos que se utilizan en la fabricación de numerosos productos, en la purificación de ciertos elementos y compuestos químicos, como desinfectante agrícola, y como fuente de hidrógeno. Se utiliza también en metalurgia, en la producción de agua pesada para la industria nuclear y como reactivo analítico.
Sulfuro de hidrógeno para vivir10,11,12
A pesar de ser un gas tóxico y maloliente, el sulfuro de hidrógeno desempeña en nuestro organismo funciones esenciales sobre diversos procesos fisiológicos, entre ellos, la reducción de la tensión arterial y la regulación del metabolismo10.
En 1987, se descubrió que el óxido nítrico (NO) actuaba como una molécula endógena capaz de actuar como gas neurotransmisor. Más tarde en la década de los 90 se descubrió un segundo gas neurotransmisor, el monóxido de carbono (CO), y tan sólo hace unos años se descubrió un tercer gas neurotransmisor, el sulfuro de hidrógeno (H2S)11.
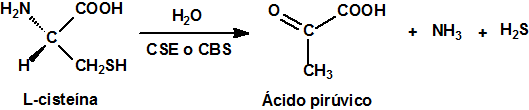
Nuestro organismo produce sulfuro de hidrógeno (H2S), aunque en muy pequeñas cantidades, en los vasos sanguíneos a través de la L-cisteina y la enzima cistationina-gamma-liasa (CSE), y en el sistema nervioso por acción de la enzima cistationina-beta-sintetasa (CBS) 10.
También se ha descubierto que se produce sulfuro de hidrógeno en el cerebro y en el endotelio vascular, por acción sobre la cisteína de la 3-mercaptopiruvato sulfotransferasa (3MST) junto con la cisteína aminotransferasa (CAT)12.
El sulfuro de hidrógeno contribuye a nuestra salud actuando sobre las células, tejidos, órganos y sistemas fisiológicos, con diversos efectos10:
- En el cerebro estimula la respuesta de los circuitos neuronales lo que podría facilitar el aprendizaje y potenciar la memoria, y promueve la producción de un antioxidante, el glutatión, que parece proteger a las neuronas de las agresiones.
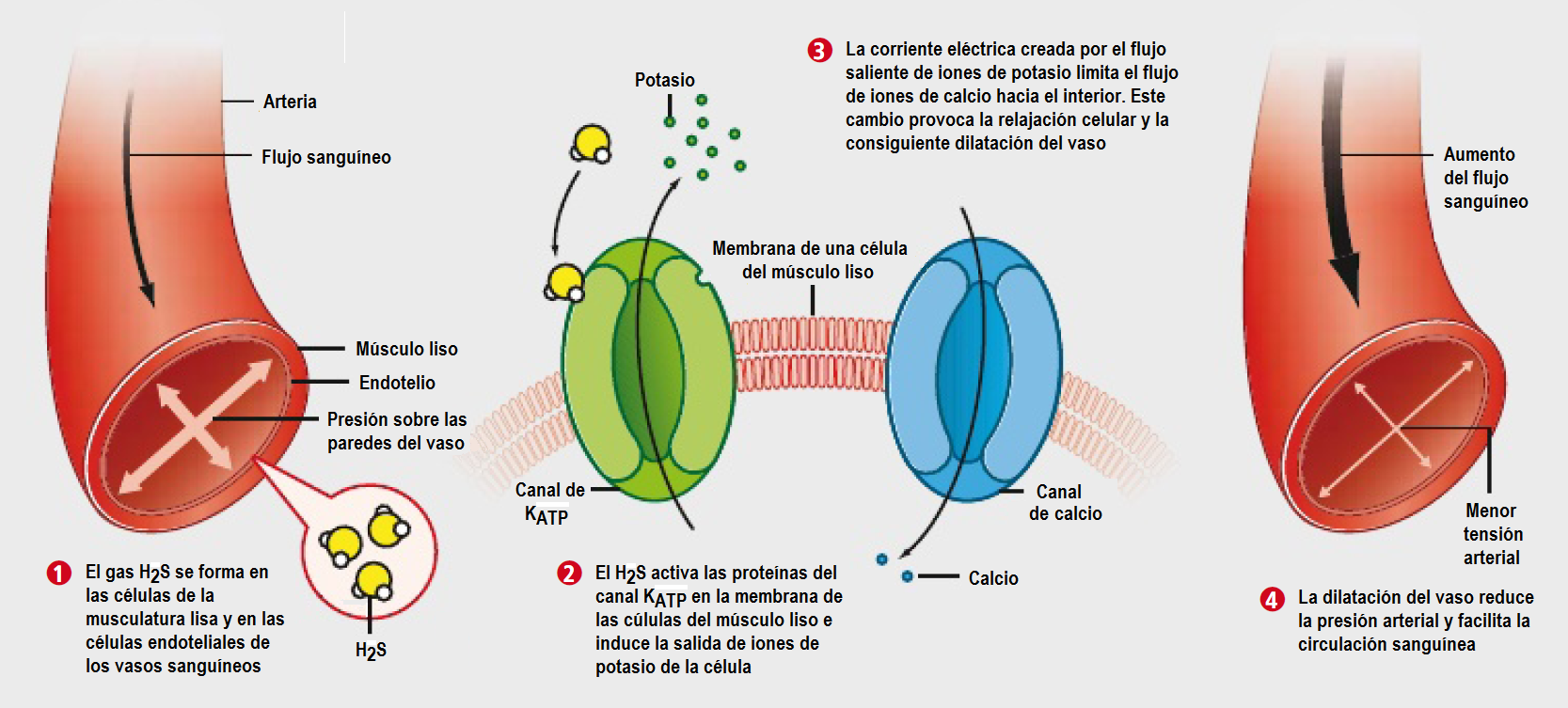
- En el sistema circulatorio dilata los vasos sanguíneos y reduce la tensión arterial, protegiendo el corazón, y podría servir para prevenir o tratar la hipertensión, el infarto de miocardio y el accidente cerebrovascular.
- En los pulmones parece que ayuda a regular la contractilidad de células de la musculatura lisa, aumentando la luz de las vías aéreas
- En los intestinos relaja células de la musculatura lisa del intestino delgado y regula así el movimiento de materiales por su interior
- En el pene relaja el tejido peniano; facilita el aflujo de sangre y la erección
Efecto dilatador producido por el H2S en los vasos sanguíneos, tomado de «La función dual del sulfuro de hidrogeno», Rui Wang, Investigación y Ciencia, Mayo 2010
Sin embargo, no todos sus efectos son beneficiosos, por ejemplo, el exceso de H2S puede mermar la síntesis de insulina y, según ciertos datos, agravar las inflamaciones.
Sulfuro de hidrógeno para morir5,13,14,15,16,17,18
En muchos campos industriales, como por ejemplo, en la agricultura, en el tratamiento de las aguas residuales y en la industria del petróleo los trabajadores pueden estar expuestos al sulfuro de hidrógeno, del orden de un tercio de los trabajadores del petróleo experimentan algún síntoma de exposición al sulfuro de hidrógeno por vía inhalatoria y un 8% de ellos llega a sufrir pérdida del conocimiento13.
Además el sulfuro de hidrógeno puede generarse con cierta facilidad a partir de algunos productos químicos simples, por lo que ha utilizado bastante en los suicidios13,14,15.
El gobierno estadounidense considera que el H2S es una amenaza química de alta prioridad tanto por su uso industrial como por su posible uso terrorista; su olor característico a huevos podridos es un arma de doble filo pues en concentraciones moderadas produce la parálisis de los nervios olfativos, engañando a la gente sobre su presencia13.
Después de su absorción, la detoxificación en nuestro organismo del H2S se realiza por oxidación enzimática y no enzimática de los sulfuros y del azufre a tiosulfato y polisulfuros. Esta reacción es catalizada por la oxihemoglobina. Según estudios recientes, el sulfuro de hidrógeno se metaboliza por oxidación a sulfato, por metilación con formación de metanotiol y sulfuro de dimetilo, y por reacción con las metaloproteínas (responsable de los efectos tóxicos más graves16,17.
Al igual que el cianuro, el H2S es un veneno celular que inhibe la citocromo C oxidasa interrumpiendo el transporte de electrones. De hecho se dice que es un inhibidor de la citocromo C oxidasa más potente que el cianuro. El resultado de la inhibición de la fosforilación oxidativa produce hipoxia celular y metabolismo anaerobio. El metabolismo anaerobio provoca una acidosis láctica. El H2S es un fuerte irritante respiratorio y reacciona con la humedad en la superficie de las membranas mucosas, formando sulfuro sódico16,17.
El olor característico, a huevos podridos, del sulfuro de hidrógeno permite su detección en concentraciones muy bajas, del orden de 0,008-0,1 ppm. Incluso a concentraciones del orden de 0,1 ppm se empieza a producir una cierta anosmia (pérdida del sentido del olfato) y a concentraciones superiores a 100 ppm no se puede percibir su olor, pues afecta al nervio olfativo. El valor del umbral de olor varía mucho según las personas y la pérdida del sentido del olfato a concentraciones elevadas puede crear en los afectados una falsa sensación de seguridad, cuando en realidad están en grave peligro.
La tabla que se muestra a continuación resume algunos de los efectos producidos por diferentes concentraciones de sulfuro de hidrógeno14,15,18:
| Concentración (ppm) | Síntomas/Efectos |
| 0,01-1,5 | Umbral de olor (olor característico a huevos podridos). |
| 2-5 | La exposición prolongada puede provocar náuseas, lagrimeo de los ojos, dolores de cabeza o pérdida del sueño. En los pacientes con asma pueden aparecer problemas en las vías respiratorias (constricción bronquial). |
| 20 | Posible fatiga, pérdida de apetito, dolor de cabeza, irritabilidad, mala memoria o mareos. |
| 50-100 | Leve conjuntivitis e irritación de las vías respiratorias al cabo de 1 hora. Puede aparecer pérdida de apetito y malestar digestivo. |
| 100 | Tos, irritación de los ojos, pérdida del olfato (anosmia) al cabo de 2-15 minutos (fatiga olfativa). Alteración respiratoria, somnolencia al cabo de 15-30 minutos. Irritación de garganta al cabo de 1 hora. Agravamiento gradual de los síntomas al cabo de varias horas. La muerte puede ocurrir después de 48 horas. |
| 100-150 | Pérdida del olfato (fatiga olfativa o parálisis). |
| 200-300 | Después de 1 hora marcada conjuntivitis e irritación de las vías respiratorias. Puede aparecer edema pulmonar tras una exposición prolongada. |
| 500-700 | Tambaleo, colapso al cabo de 5 minutos. Daños graves en los ojos al cabo de 30 minutos. Muerte después de 30-60 minutos. |
| 700-1000 | Pérdida rápida del conocimiento, desmayo o colapso inmediato con tan solo 1 ó 2 inhalaciones, parada respiratoria, muerte al cabo de unos minutos. |
| 1000-2000 | Muerte casi instantánea. |
La exposición al sulfuro de hidrógeno por vía inhalatoria produce generalmente dolor de cabeza, náuseas, vértigo, mareos, debilidad, desorientación, hipotensión e irritación respiratoria. La lesión pulmonar puede progresar a lo largo de algunas horas. La intoxicación grave con sulfuro de hidrógeno puede causar inconsciencia, fallo respiratorio y cardiovascular. Es característico en exposiciones elevadas la pérdida rápida de la consciencia o «desmayo». Los pacientes que vuelven a despertarse pueden experimentar un síndrome confusional agudo, con agitación y confusión5.
La exposición de los ojos a bajas concentraciones de sulfuro de hidrógeno gas causa molestias por quemadura, parpadeo espasmódico o cierre involuntario de los párpados, enrojecimiento y lagrimeo. A altas concentraciones o exposiciones repetidas pueden aparecer opacidades en la córnea5.
Si la piel está mojada o húmeda el contacto con la piel del sulfuro de hidrógeno gas puede causar irritación y el contacto de la piel con sulfuro de hidrógeno líquido (licuado por presión) puede dar lugar a congelaciones5.
Si el paciente sobrevive las primeras 48 horas después de la exposición, es probable la recuperación. Después de una exposición aguda, la función pulmonar vuelve a su estado normal en 7-14 días. Es habitual la recuperación completa; sin embargo, los síntomas y deficiencias pulmonares pueden mantenerse. La hiperreactividad de las vías respiratorias a irritantes no específicos pueden persistir, resultando en broncospasmos e inflamación crónica de los bronquios. El síndrome de disfunción de las vías respiratorias reactivas puede persistir durante años. Las secuelas de cicatrices y destrucción en el tejido pulmonar pueden conducir a una dilatación crónica de los bronquios y a una gran susceptibilidad de infección. Pueden producirse secuelas neurológicas como resultado de la insuficiencia respiratoria5.
Referencias
- «Australian police charge two men over plane bomb plot», http://www.aljazeera.com/news/2017/08/australian-police-charge-men-plane-bomb-plot-170804003917635.html
- «Australia terror plot: Brother likely ‘had no idea’ bomb was in luggage, police say», http://www.foxnews.com/world/2017/08/04/australia-terror-plot-brother-likely-had-no-idea-bomb-was-in-luggage-police-say.html
- «Foiled plot to blow up plane, unleash gas revealed in Australia», http://edition.cnn.com/2017/08/03/asia/australia-plane-terror-plot-isis/index.html
- «Japanese experience of hydrogen sulfide: the suicide craze in 2008», D. Morii, Y. Miyagatani, N. Nakamae, M. Murao & K. Taniyama, Journal of Occupational Medicine and Toxicology 2010, 5:28
- «FDS sulfuro de hidrógeno», Murcia Salud, 2007, http://www.murciasalud.es/recursos/ficheros/114700-sulfuro_de_hidrogeno.pdf
- «FDS sulfuro de hidrógeno», Praxair, 2014, http://www.praxair.com.mx/-/media/documents/safety-data-sheets/sulfuro-de-hidrogeno-hds-p4611g-2009.pdf
- «FDS sulfuro de hidrógeno», NJHealth, 2012, http://nj.gov/health/eoh/rtkweb/documents/fs/1017sp.pdf
- «Atlas d´équilibres électrochimiques à 25 °C», Marcel Pourbaix, GV, 1963
- «Hydrogen sulfide-human health aspects», WHO, 2003
- «La función dual del sulfuro de hidrogeno», Rui Wang, Investigación y Ciencia, Mayo 2010
- «Hydrogen Sulfide-The Third Gasotransmitter in Biology and Medicine», Rui Wang, Antioxidants & redox signaling, Volume 12, Number 9, 2010
- «H2S Synthesizing Enzymes: Biochemistry and Molecular Aspects», Caleb Weihao Huang and Philip Keith Moore, en «Chemistry, Biochemistry and Pharmacology of Hydrogen Sulfide», Philip K. Moore & Matt Whiteman, Springer, 2015
- «Hydrogen Sulfide-Mechanisms of Toxicity and Development of an Antidote», J. Jiang & Others, Scientific Reports 6, Article number: 20831 (2016), https://www.nature.com/articles/srep20831.pdf
- «Japanese experience of hydrogen sulfide: the suicide craze in 2008», D. Morii, Y. Miyagatani, N. Nakamae, M. Murao & K. Taniyama, Journal of Occupational Medicine and Toxicology 2010, 5:28
- «Suicide by Hydrogen Sulfide Inhalation», Eleanor Bott & Malcolm Dodd, Am J Forensic Med Pathol, Volume 34, Number 1, March 2013
- «Modern Medical Toxicology»,V.V. Pillay, Jaypee Brothers Medical Publishers, 4th Ed., 2013
- «A critical review of the literature on hydrogen sulfide toxicity», O. Beauchamp, J. S. Bus, J. A. Popp, C. J. Boreiko & D. A. Andjelkovich, Crit Rev Toxicol. 1984; 13(1):25-97
- «Hydrogen Sulfide (H2S) Code of Practice», Cenovus, 2015, http://www.cenovus.com/contractor/docs/health-safety-practices/hydrogen-sulfide-code-of-practice.pdf