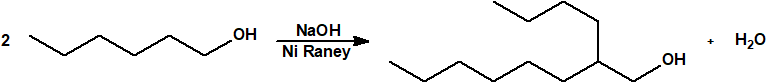
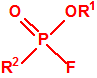
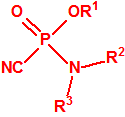
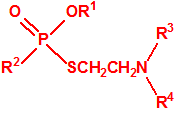
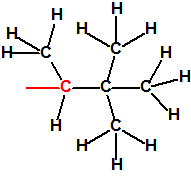
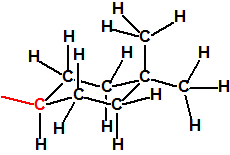
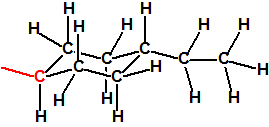
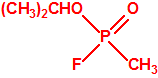
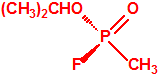
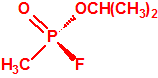
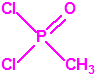
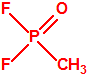
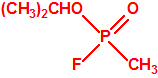
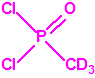
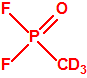
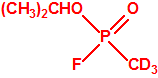
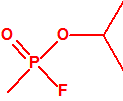
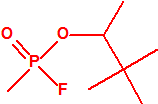
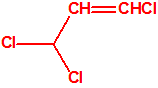
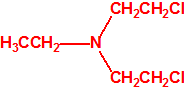
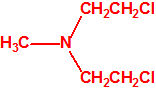
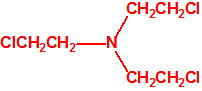
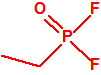
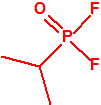
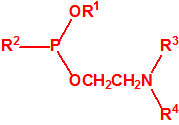
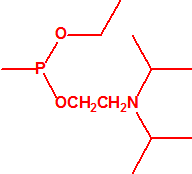
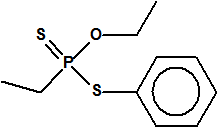
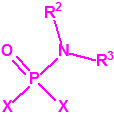
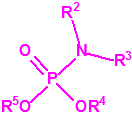
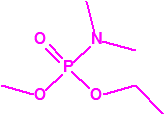
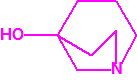
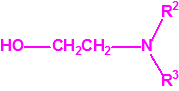
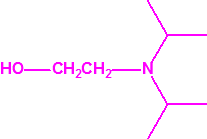
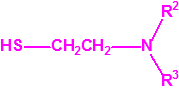
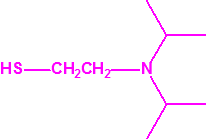
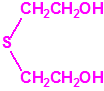
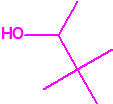
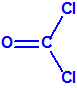
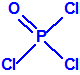
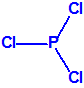
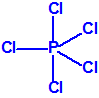
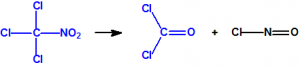
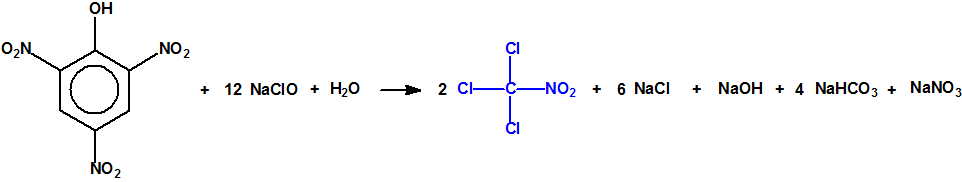
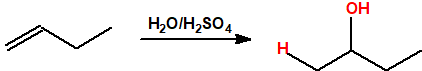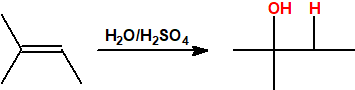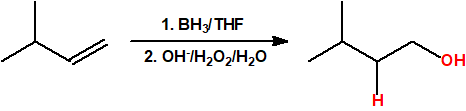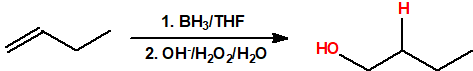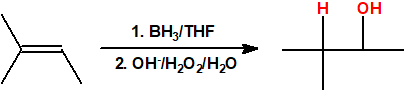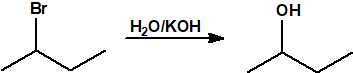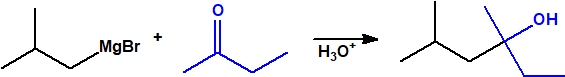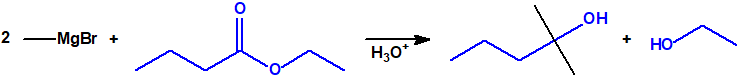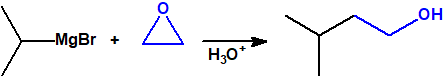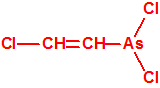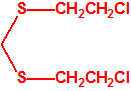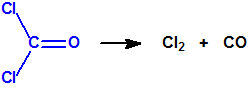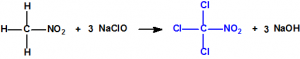Para empezar, recordemos que en su artículo II, punto 3, la Convención para la prohibición de las Armas Químicas (CAQ) entiende por «precursor»1:
«Cualquier reactivo químico que intervenga en cualquier fase de la producción por cualquier método de una sustancia química tóxica. Queda incluido cualquier componente clave de un sistema químico binario o de multicomponentes.»
(A los efectos de la aplicación de la CAQ, los precursores respecto de los que se ha previsto la aplicación de medidas de verificación están enumerados en Listas incluidas en el Anexo sobre sustancias químicas.)
Y según el punto 4 de ese mismo artículo, se entiende por «componente clave de sistemas químicos binarios o de multicomponentes»1:
«El precursor que desempeña la función más importante en la determinación de las propiedades tóxicas del producto final y que reacciona rápidamente con otras sustancias químicas en el sistema binario o de multicomponentes.»
Los alcoholes son precursores de multitud de agentes químicos de guerra, y además son, en algunos casos, componentes de sistemas químicos binarios o de multicomponentes.
Los alcoholes y la CAQ1,2
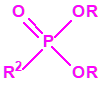
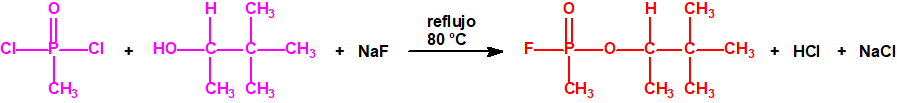
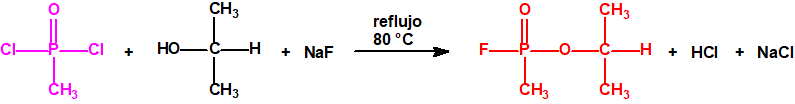
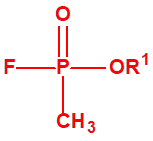
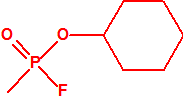
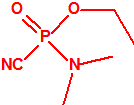
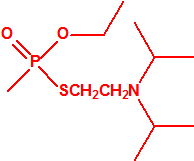
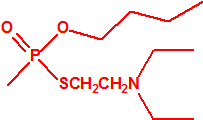
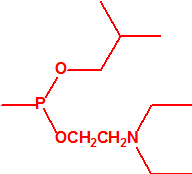
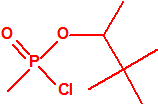
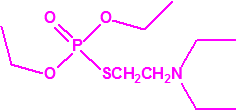
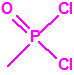
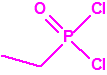
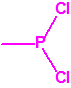
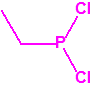
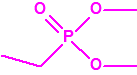
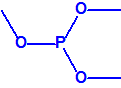
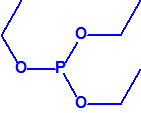
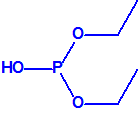
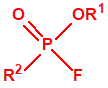
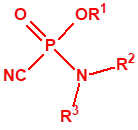
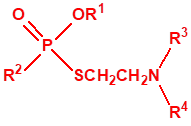
A efectos de verificación la CAQ recoge en su anexo sobre sustancias químicas miles de sustancias químicas del tipo ésteres fosfóricos o ésteres fosfónicos, donde el resto alquílico del éster puede ser una cadena carbonada lineal, o más o menos ramificada, o incluso con ciclos, que no tenga más de 10 átomos de carbono:
 |
 |
 |
|
1A.1 |
1A.2 |
1A.3 |
|
2B.4 |
Pese a la existencia de miles de ésteres en las Listas de la CAQ, tan solo unos pocos alcoholes están recogidos en ellas, lo que indica claramente que no todos los alcoholes son iguales:
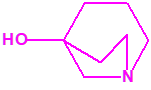 |
 |
|
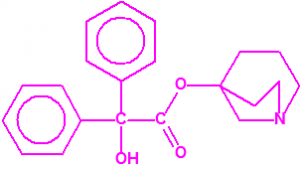
2B.9 Quinuclidinol-3 CAS 1619-34-7 |
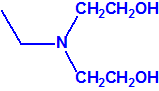
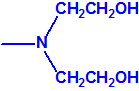
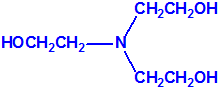
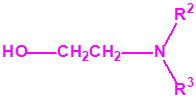
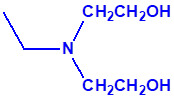
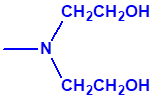
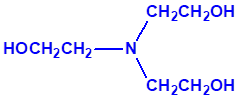
2B.11 N,N-dialquilaminoetan-2-oles |
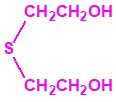 |
 |
|
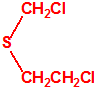
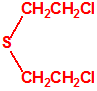
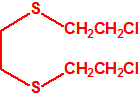
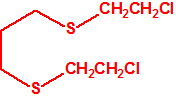
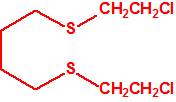
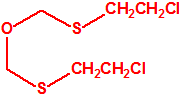
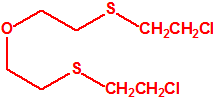
2B.13 Tiodiglicol CAS 111-48-8 |
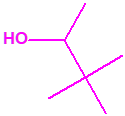
2B.14 Alcohol pinacolilico (3,3-dimetilbutan-2-ol) CAS 464-07-3 |
 |
 |
 |
|
3B.15 Etildietanolamina CAS 139-87-7 |
3B.16 Metildietanolamina CAS 105-59-9 |
3B.17 Trietanolamina CAS 102-71-6 |
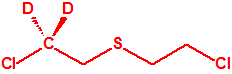
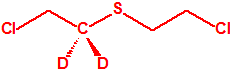
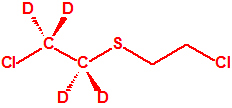
Todos los alcoholes listados tienen, además de sus fines no prohibidos por la CAQ, una aplicación más o menos directa para la síntesis de algunos agentes químicos de guerra, por ejemplo:
|
|
|
|
Se da la circunstancia de que muchos alcoholes, que son sustancias muy utilizadas para fines no prohibidos por la CAQ, no están incluidos, ni en las Listas de la CAQ, ni en las listas del Grupo Australia, y sin embargo son precursores para la síntesis de los ésteres organofosforados incluídos en las Listas.
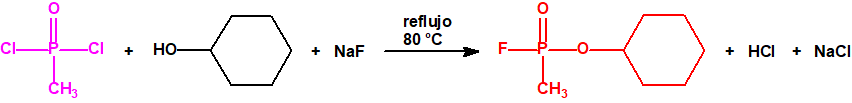
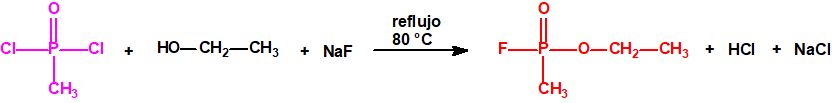
Por ejemplo, ni el isopropanol, ni el ciclohexanol, ni el etanol están incluidos en las Listas de la CAQ, y tampoco están incluidos en el Grupo Australia, pero son precursores para la síntesis del sarín, ciclosarín y etilsarín, respectivamente:
Destrucción de las armas químicas1
En el anexo sobre la aplicación y la verificación, en su Parte IV(A) relativa a la destrucción de armas químicas y su verificación, en el artículo 2 se indica:
…
-
- los casos de mezclas de dos o más sustancias químicas, se identificará cada una de ellas, indicándose los porcentajes respectivos, y la mezcla se declarará con arreglo a la categoría de la sustancia química más tóxica. Si un componente de un arma química binaria está constituido por una mezcla de dos o más sustancias químicas, se identificará cada una de ellas y se indicará el porcentaje respectivo;
- Las armas químicas binarias se declararán con arreglo al producto final pertinente dentro del marco de las categorías de armas químicas mencionadas en el párrafo 16. Se facilitará la siguiente información complementaria respecto de cada tipo de munición química binaria/dispositivo químico binario:
i) El nombre químico del producto tóxico final;
ii) La composición química y la cantidad de cada componente;
iii) La relación efectiva de peso entre los componentes;
iv) Qué componente se considera el componente clave;
v) La cantidad proyectada del producto tóxico final calculada sobre una base estequiométrica a partir del componente clave, suponiendo que el rendimiento sea del 100%. Se considerará que la cantidad declarada (en toneladas) del componente clave destinada a un producto tóxico final específico equivale a la cantidad (en toneladas) de ese producto tóxico final calculada sobre una base estequiométrica, suponiendo que el rendimiento sea del 100%;
Y en el artículo 18 de esta Parte IV(A) relativa a la destrucción de armas químicas y su verificación, se indica:
Para la destrucción de las armas químicas binarias se aplicará lo siguiente:
- A los efectos del orden de destrucción, se considerará que la cantidad declarada (en toneladas) del componente clave destinada a un producto final tóxico específico equivale a la cantidad (en toneladas) de ese producto final tóxico calculada sobre una base estequiométrica, suponiendo que el rendimiento sea del 100%;
- La exigencia de destruir una cantidad determinada del componente clave implicará la exigencia de destruir una cantidad correspondiente del otro componente, calculada a partir de la relación efectiva de peso de los componentes en el tipo pertinente de munición química binaria/dispositivo químico binario;
- Si se declara una cantidad mayor de la necesaria del otro componente, sobre la base de la relación efectiva de peso entre componentes, el exceso consiguiente se destruirá a lo largo de los dos primeros años siguientes al comienzo de las operaciones de destrucción;
- Al final de cada año operacional siguiente, cada Estado Parte podrá conservar una cantidad del otro componente declarado determinada sobre la base de la relación efectiva de peso de los componentes en el tipo pertinente de munición química binaria/dispositivo químico binario.
Esto supone que si se declarase la posesión de un componente clave de un sistema de munición química binaria, por ejemplo, si se declarasen 100 kg de DF (que con un peso molecular de 100,00 suponen 1000 moles), habría que destruir 1000 moles de un alcohol, por ejemplo, de 3,3-dimetil-2-butanol (CAS 464-07-3, Lista 2B.14), de 2-propanol (CAS 67-63-0, no listado), de 2-butanol (CAS 78-83-1, no listado), de 2,2-dimetil-1-propanol (CAS 75-84-3, no listado), o de cualquier otro de los muchos alcoholes no listados.
Guerra química
En guerra química la elección del alcohol viene condicionada por la toxicidad del agente y la disponibilidad o facilidad de síntesis del alcohol.
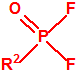
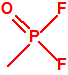
La siguiente tabla muestra la toxicidad en conejos, por vía intravenosa, para diferentes metilfosfonofluoridatos de O-alquilo, sarín, somán y ciclosarín, entre otros, y como puede observarse son bastante similares. En caso de requerirse un agente químico de guerra del tipo «metilfosfonofluoridato de O-alquilo» es probable que la obtención del mismo venga condicionada en gran medida por la disponibilidad del alcohol correspondiente3.
De los alcoholes, los ésteres
La cadena carbonada lineal, o más o menos ramificada, o incluso con ciclos, que no tenga más de 10 átomos de carbono, enlazada al átomo de fósforo a través de un átomo de oxígeno, se correspondería con el alcohol esterificado. Conforme aumenta el número de átomos de carbono del alcohol aumenta de manera importante el número de isómeros posibles. La siguiente tabla muestra los posibles alcoholes de C1 a C8, con su número CAS (no se incluyen los ciclos, ni los isómeros ópticos):
C1
|
Metanol, CAS 67-56-1 |
|
C2 |
|
Etanol, CAS 64-17-5 |
|
C3 |
|
Propanol, CAS 71-23-8 |
|
Isopropanol, CAS 67-63-0 |
|
C4 |
|
1-butanol, CAS 71-36-3 |
|
2-butanol, CAS 78-83-1 |
|
1-metil-1-propanol, CAS 78-92-2 |
|
1,1-dimetil-1-propanol, CAS 75-65-0 |
|
C5 |
|
1-pentanol, CAS 71-41-0 |
|
2-pentanol, CAS 6032-29-7 |
|
3-pentanol, CAS 584-02-1 |
|
2-metil-1-butanol, CAS 137-32-6 |
|
3-metil-1-butanol, CAS 123-51-3 |
|
2-metil-2-butanol, CAS 75-85-4 |
|
3-metil-2-butanol, CAS 598-75-4 |
|
2,2-dimetil-1-propanol, CAS 75-84-3 |
|
C6 |
|
1-hexanol, CAS 111-27-3 |
|
2-hexanol, CAS 626-93-7 |
|
3-hexanol, CAS 623-37-0 |
|
2-metil-1-pentanol, CAS 105-30-6 |
|
3-metil-1-pentanol, CAS 589-35-5 |
|
4-metil-1-pentanol, CAS 626-89-1 |
|
2-metil-2-pentanol, CAS 590-36-1 |
|
3-metil-2-pentanol, CAS 565-60-6 |
|
4-metil-2-pentanol, CAS 108-11-2 |
|
3-metil-3-pentanol, CAS 77-74-7 |
|
4-metil-3-pentanol, CAS 565-67-3 |
|
2,2-dimetil-1-butanol, CAS 1185-33-7 |
|
2-etil-1-butanol, CAS 97-95-0 |
|
2,3-dimetil-1-butanol, CAS 49550-30-2 |
|
3,3-dimetil-1-butanol, CAS 624-95-3 |
|
2,3-dimetil-2-butanol, CAS 594-60-5 |
|
3,3-dimetil-2-butanol, CAS 464-07-3 (en Lista 2B.14 de la CAQ) |
|
C7 |
|
1-heptanol, CAS 111-70-6 |
|
2-heptanol, CAS 543-49-7 |
|
3-heptanol, CAS 589-82-2 |
|
4-heptanol, CAS 589-55-9 |
|
2-metil-1-hexanol, CAS 624-22-6 |
|
3-metil-1-hexanol, CAS 13231-81-7 |
|
4-metil-1-hexanol, CAS 818-49-5 |
|
5-metil-1-hexanol, CAS 627-98-5 |
|
2-metil-2-hexanol, CAS 625-23-0 |
|
3-metil-2-hexanol, CAS 2313-65-7 |
|
4-metil-2-hexanol, CAS 2313-61-3 |
|
5-metil-2-hexanol, CAS 627-59-8 |
|
2-metil-3-hexanol, CAS 617-29-8 |
|
3-metil-3-hexanol, CAS 597-96-6 |
|
4-metil-3-hexanol, CAS 615-29-2 |
|
5-metil-3-hexanol, CAS 623-55-2 |
|
2,2-dimetil-1-pentanol, CAS 2370-12-9 |
|
3,3-dimetil-1-pentanol, CAS 19264-94-9 |
|
4,4-dimetil-1-pentanol, CAS 3121-79-7 |
|
2-etil-1-pentanol, CAS 27522-11-8 |
|
3-etil-1-pentanol, CAS 66225-51-2 |
|
2,3-dimetil-2-pentanol, CAS 4911-70-0 |
|
2,4-dimetil-2-pentanol, CAS 625-06-9 |
|
3,3-dimetil-2-pentanol, CAS 19781-24-9 |
|
4,4-dimetil-2-pentanol, CAS 6144-93-0 |
|
3,4-dimetil-1-pentanol, CAS 6570-87-2 |
|
2,3-dimetil-1-pentanol, CAS 10143-23-4 |
|
2,4-dimetil-1-pentanol, CAS 6305-71-1 |
|
3-etil-2-pentanol, CAS 609-27-8 |
|
3,4-dimetil-2-pentanol, CAS 64502-86-9 |
|
2,2-dimetil-3-pentanol, CAS 3970-62-5 |
|
2,4-dimetil-3-pentanol, CAS 600-36-2 |
|
3-etil-3-pentanol, CAS 597-49-9 |
|
2,3-dimetil-3-pentanol, CAS 595-41-5 |
|
2,2,3-trimetil-1-butanol, CAS 55505-23-2 |
|
2,3,3-trimetil-1-butanol, CAS 36794-64-6 |
|
2-etil-3-metil-1-butanol, CAS 32444-34-1 |
|
2-etil-2-metil-1-butanol, CAS 18371-13-6 |
|
2,3,3-trimetil-2-butanol, CAS 594-83-2 |
|
C8 |
|
1-octanol, CAS 111-87-5 |
|
2-octanol, CAS 123-96-6 |
|
3-octanol, CAS 589-98-0 |
|
4-octanol, CAS 589-62-8 |
|
2-metil-1-heptanol, CAS 60435-70-3 |
|
2-metil-2-heptanol, CAS 625-25-2 |
|
2-metil-3-heptanol, CAS 18720-62-2 |
|
2-metil-4-heptanol, CAS 21570-35-4 |
|
3-metil-1-heptanol, CAS 1070-32-2 |
|
3-metil-2-heptanol, CAS 31367-46-1 |
|
3-metil-3-heptanol, CAS 5582-82-1 |
|
3-metil-4-heptanol, CAS 1838-73-9 |
|
4-metil-1-heptanol, CAS 817-91-4 |
|
4-metil-2-heptanol, CAS 56298-90-9 |
|
4-metil-3-heptanol, CAS 14979-39-6 |
|
4-metil-4-heptanol, CAS 598-01-6 |
|
5-metil-1-heptanol, CAS 7212-53-5 |
|
5-metil-2-heptanol, CAS 54630-50-1 |
|
5-metil-3-heptanol, CAS 18720-65-5 |
|
6-metil-1-heptanol, CAS 1653-40-3 |
|
6-metil-2-heptanol, CAS 4730-22-7 |
|
6-metil-3-heptanol, CAS 18720-66-6 |
|
2,2-dimetil-1-hexanol, CAS 2370-13-0 |
|
2,2-dimetil-3-hexanol, CAS 4209-90-9 |
|
2,3-dimetil-1-hexanol, CAS 19550-02-8 |
|
2,3-dimetil-2-hexanol, CAS 19550-03-9 |
|
2,3-dimetil-3-hexanol, CAS 4166-46-5 |
|
2,4-dimetil-1-hexanol, CAS 3965-59-1 |
|
2,4-dimetil-2-hexanol, CAS 42328-76-7 |
|
2,4-dimetil-3-hexanol, CAS 13432-25-2 |
|
2,5-dimetil-1-hexanol, CAS 6886-16-4 |
|
2,5-dimetil-2-hexanol, CAS 3730-60-7 |
|
2,5-dimetil-3-hexanol, CAS 19550-07-3 |
|
3,3-dimetil-1-hexanol, CAS 10524-70-6 |
|
3,3-dimetil-2-hexanol, CAS 22025-20-3 |
|
3,4-dimetil-1-hexanol, CAS 66576-57-6 |
|
3,4-dimetil-2-hexanol, CAS 19550-05-1 |
|
3,4-dimetil-3-hexanol, CAS 19550-08-4 |
|
3,5-dimetil-1-hexanol, CAS 13501-73-0 |
|
3,5-dimetil-2-hexanol, CAS 66576-27-0 |
|
3,5-dimetil-3-hexanol, CAS 4209-91-0 |
|
4,4-dimetil-1-hexanol, CAS 6481-95-4 |
|
4,4-dimetil-2-hexanol, CAS 66576-28-1 |
|
4,4-dimetil-3-hexanol, CAS 19550-09-5 |
|
4,5-dimetil-1-hexanol, CAS 60564-76-3 |
|
4,5-dimetil-2-hexanol, CAS 66576-29-2 |
|
4,5-dimetil-3-hexanol, CAS 66576-30-5 |
|
5,5-dimetil-1-hexanol, CAS 2768-18-5 |
|
5,5-dimetil-2-hexanol, CAS 31841-77-7 |
|
5,5-dimetil-3-hexanol, CAS 66576-31-6 |
|
2-etil-1-hexanol, CAS 104-76-7 |
|
3-etil-1-hexanol, CAS 41065-95-6 |
|
3-etil-2-hexanol, CAS 24448-19-9 |
|
3-etil-3-hexanol, CAS 597-76-2 |
|
4-etil-1-hexanol, CAS 66576-32-7 |
|
4-etil-2-hexanol, CAS 66576-33-8 |
|
4-etil-3-hexanol, CAS 19780-44-0 |
|
2,2,3-trimetil-1-pentanol, CAS 57409-53-7 |
|
2,2,3-trimetil-3-pentanol, CAS 7294-05-5 |
|
2,2,4-trimetil-1-pentanol, CAS 123-44-4 |
|
2,2,4-trimetil-3-pentanol, CAS 5162-48-1 |
|
2,3,3-trimetil-1-pentanol, CAS 66576-25-8 |
|
2,3,3-trimetil-2-pentanol, CAS 23171-85-9 |
|
2,3,4-trimetil-1-pentanol, CAS 6570-88-3 |
|
2,3,4-trimetil-2-pentanol, CAS 66576-26-9 |
|
2,3,4-trimetil-3-pentanol, CAS 3054-92-0 |
|
2,4,4-trimetil-1-pentanol, CAS 16325-63-6 |
|
2,4,4-trimetil-2-pentanol, CAS 690-37-9 |
|
3,3,4-trimetil-1-pentanol, CAS 65502-58-1 |
|
3,3,4-trimetil-2-pentanol, CAS 19411-41-7 |
|
3,4,4-trimetil-1-pentanol, CAS 16325-64-7 |
|
3,4,4-trimetil-2-pentanol, CAS 10575-56-1 |
|
2-etil-2-metil-1-pentanol, CAS 5970-63-8 |
|
2-etil-3-metil-1-pentanol, CAS 66576-35-0 |
|
2-etil-4-metil-1-pentanol, CAS 106-67-2 |
|
3-etil-2-metil-1-pentanol, CAS 66576-34-9 |
|
3-etil-2-metil-2-pentanol, CAS 19780-63-3 |
|
3-etil-2-metil-3-pentanol, CAS 597-05-7 |
|
3-etil-3-metil-1-pentanol, CAS 10524-71-7 |
|
3-etil-3-metil-2-pentanol, CAS 66576-22-5 |
|
3-etil-4-metil-1-pentanol, CAS 38514-13-5 |
|
3-etil-4-metil-2-pentanol, CAS 66576-23-6 |
|
2-propil-1-pentanol, CAS 58175-57-8 |
|
2-(1-metiletil)-1-pentanol, CAS 18593-91-4 |
|
2-etil-3,3-dimetil-1-butanol, CAS 66576-56-5 |
|
2-etil-2,3-dimetil-1-butanol, CAS 66576-55-4 |
|
2,2-dietil-1-butanol, CAS 13023-60-4 |
|
3-metil-2-(1-metiletil)-1-butanol, CAS 18593-92-5 |
|
2,2,3,3-tetrametil-1-butanol, CAS 66576-24-7 |
De los 161 alcoholes de esta lista solo el 3,3-dimetil-2-butanol (alcohol pinacolílico), CAS 464-07-3 está en las Listas de la CAQ, concretamente en la Lista 2B.14.
Los alcoholes se usan como disolventes y diluyentes para pinturas (principalmente alcoholes C1-C6), como intermedios en la fabricación de ésteres y de toda una gama de compuestos orgánicos, como agentes de flotación, como lubricantes, y como combustibles o aditivos de combustible. Para fines industriales, a menudo se prefieren las mezclas isoméricas porque los alcoholes puros son demasiado caros. Además, las mezclas de alcoholes con diferentes números de átomos de carbono pueden ser ventajosas para ciertos fines. Por lo tanto, las cantidades de mezclas de alcohol disponibles en el mercado son similares a las cantidades de los alcoholes puros individuales.
Desde el punto de vista industrial los alcoholes más importantes son metanol, etanol, 1-propanol, 2-propanol (alcohol isopropílico), 1-butanol, 2-metil-1-propanol (alcohol isobutílico), los alcoholes plastificantes (C6 – C11) y los alcoholes grasos (C12 – C18), utilizados para detergentes.
Métodos de preparación de alcoholes4,5,6,7,8
Existen muchos y muy diversos métodos de laboratorio para la preparación de alcoholes, que aparecen descritos en los múltiples libros sobre química orgánica. A modo de resumen podemos citar los siguientes:
- Hidratación de alquenos. La reacción de hidratación sigue la regla de Markovnikov, es decir, el protón se adiciona al carbono menos sustituido del alqueno y el grupo hidroxilo se adiciona al carbono más sustituido del alqueno.
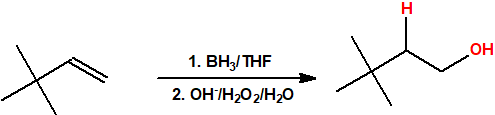
- Hidroboración seguida de oxidación. La hidroboración es una reacción en la cual un alqueno reacciona con un hidruro de boro para formar un organoborano que posteriormente es oxidado con peróxido de hidrógeno en medio básico para obtener un alcohol. La reacción de hidroboración sigue la regla anti-Markovnikov, es decir, el protón se adiciona al carbono más sustituido del alqueno y el grupo hidroxilo se adiciona al carbono menos sustituido del alqueno.
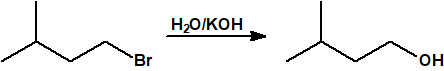
- Hidrólisis de los halogenuros de alquilo. La hidrólisis de los halogenuros de alquilo es una reacción de sustitución nucleófila que permite la obtención del correspondiente alcohol. La utilidad de esta reacción de sustitución viene limitada por la competencia de la reacción de eliminación de halogenuro de hidrógeno que produce el correspondiente alqueno.
- Hidrólisis de los halogenuros de alquilo. La hidrólisis de los halogenuros de alquilo es una reacción de sustitución nucleófila que permite la obtención del correspondiente alcohol. La utilidad de esta reacción de sustitución viene limitada por la competencia de la reacción de eliminación de halogenuro de hidrógeno que produce el correspondiente alqueno.
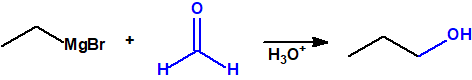
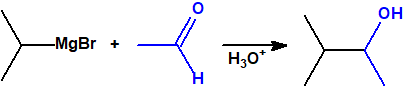
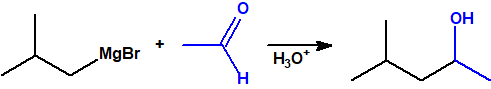
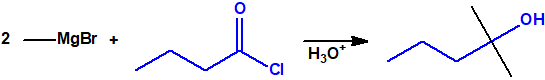
- Reacción de adición nucleófila de reactivos de Grignard al grupo carbonilo (aldehídos, cetonas, ésteres y acil derivados) y a epóxidos. Mediante este procedimiento se pueden obtener ácoholes primarios, secundarios y terciarios:
-
- Alcoholes primarios. Cuando la adición se lleva a cabo sobre el metanal.
-
- Alcoholes secundarios. Cuando la adición se lleva a cabo sobre cualquier otro aldehído:
-
- Alcoholes terciarios. Cuando la adición se lleva a cabo sobre una cetona:
-
- Reacciones con ésteres y halogenuros (haluros) de ácido. Los reactivos de Grignard reaccionan con estos derivados de ácido dando alcoholes terciarios, pero se requieren dos equivalentes del reactivo de Grignard por cada equivalente del derivado de ácido:
-
- Reacciones con epóxidos. Normalmente con óxido de metileno, para así obtener alcoholes primarios:
- Reducción de compuestos carbonílicos. Para la reducción de los compuestos carbonílicos se suelen emplear hidruros, como el NaBH4 que es muy selectivo y no reduce ni los ácidos ni los ésteres, o el LiAlH4 que es un reactivo más enérgico que reduce también los ácidos, los ésteres y otros derivados de ácidos. Normalmente los aldehídos se reducen a alcoholes primarios y las cetonas a alcoholes secundarios. Los ácidos y ésteres se reducen a alcoholes primarios.
A escala industrial podemos citar los siguientes procesos:
- Síntesis a partir de monóxido de carbono e hidrógeno (para el metanol)
- Oxosíntesis (la mayor parte de las veces combinada con hidrogenación de los aldehídos formados inicialmente; alcoholes de C3 a C20)
- Hidrogenación de aldehídos, ácidos carboxílicos o ésteres.
- Condensación aldólica de aldehídos inferiores e hidrogenación de los alquenilos (C3→C6, C4→C8, C8→C16)
- Oxidación de compuestos de trialquilaluminio (proceso Ziegler)
- Oxidación de hidrocarburos saturados.
- Hidratación de olefinas (alcoholes de C2 a C4)
- Homologación de alcoholes
- Hidrocarbonilación mediante el proceso Reppe
- Hidrocarboximetilación
- Procesos de fermentación (alcoholes de C2 a C5)
- Proceso Guerbet
Probablemente los procesos industriales más importantes son la síntesis de metanol y la oxosíntesis, aunque la hidratación de etileno y de propeno a etanol y a 2-propanol, y la oxidación de los compuestos de trialquilaluminio (proceso Alfol o proceso Ziegler) también ha logrado una considerable importancia comercial. La fermentación, especialmente para la producción de etanol, ha vuelto a ser importante en ciertas regiones debido al aumento de precio del petróleo.
Síntesis a partir de monóxido de carbono e hidrógeno (para el metanol)4
Sólo el metanol se prepara a partir de gas de síntesis (El gas de síntesis, que contiene cantidades variables de monóxido de carbono (CO) e hidrógeno (H2), es un combustible gaseoso obtenido sometiendo ciertas sustancias ricas en carbono (hulla, carbón, coque, nafta, biomasa, etc.) a un proceso químico a alta temperatura):
CO + H2 ⇔ CH3OH
CO2 + H2 ⇔ CH3OH + H2O
CO2 + H2 ⇔ CO + H2O
Oxosíntesis4,9
Los alcoholes en el rango C3-C20 pueden prepararse mediante oxosíntesis, haciendo reaccionar olefinas con gas de síntesis (CO + H2) para formar aldehídos usando la reacción de hidroformilación, y luego hidrogenando el aldehído para obtener el alcohol:
R-CH=CH2 + CO + 2 H2 → R-CH2CH2CH2OH
Algunas veces se aplica una etapa intermedia para agregar dos aldehídos y obtener un aldehído con mayor número de átomos de carbono (reacción de condensación aldólica), antes de proceder a la hidrogenación. Una versión particular de la oxosíntesis es el proceso Shell, en el cual la fuerte actividad hidrogenante del catalizador, HCo(CO)3PR3, conduce a la hidrogenación directa en el reactor oxo del aldehído inicialmente formado.
Los principales alcoholes obtenidos mediante este proceso (oxo-alcoholes) son: 1-butanol (CAS 71-36-3), 2-metil-2-butanol (CAS ), 2-etil-1-hexanol (CAS 75-85-4), 2-propil-1-heptanol (CAS 10042-59-8), 7-metil-1-octanol (CAS 27458-94-2) y 8-metil-1-nonanol (25339-17-7)
Hidrogenación de aldehídos, ácidos carboxílicos o ésteres4
Los aldehídos se pueden hidrogenar en presencia de catalizadores homogéneos o heterogéneos. Generalmente se prefieren catalizadores heterogéneos que son efectivos tanto en fase gaseosa a temperaturas de 90-180 °C y presiones de 25 bar, como en fase líquida a temperaturas de 80-220 °C y presiones de hasta 300 bar. La temperatura de hidrogenación empleada en los distintos procesos industriales es un compromiso entre el menor consumo energético posible y la más larga vida útil del catalizador.
Condensación aldólica de aldehídos inferiores e hidrogenación de los alquenales4 (C3→C6, C4→C8, C8→C16)
En la industria, la única fuente de aldehídos para la condensación aldólica es la oxosíntesis. Después de eliminados los isoaldehídos y otros subproductos, se realiza la condensación catalizada por ácidos o bases. Dado que la reactividad de cada aldehído depende de la longitud de la cadena y del grado de ramificación, las condiciones de reacción deben adaptarse para cada aldehído en particular. Los aldehídos insaturados (alquenales), formados por eliminación de agua en los aldoles, se hidrogenan sobre catalizadores heterogéneos.
Mediante este método, se preparan 2-etilhexanol, 2-metilpentanol y cantidades limitadas de alcoholes isómeros C16 y C18 altamente ramificados.
Oxidación de compuestos de trialquilaluminio (proceso Ziegler)4
El etileno puede agregarse al trietilaluminio para formar una mezcla de compuestos de trialquilaluminio de mayor masa molecular. Estos productos pueden oxidarse con aire a loscorrespondientes alcóxidos de aluminio, que luego se hidrolizan a una mezcla de alcoholes primarios lineales con el mismo número de átomos de carbono que los grupos alquilo que constituyen el trialquilaluminio:
Al(CH2CH3)3 + 3x CH2=CH2 → Al((CH2CH2)xCH2CH3)3
Al((CH2CH2)xCH2CH3)3 + 3/2 O2 → Al(O(CH2CH2)xCH2CH3)3
Al(O(CH2CH2)xCH2CH3)3 + 3 H2O → Al(OH)3 + 3 HO(CH2CH2)xCH2CH3
Esta reacción conocida como proceso Ziegler (también como síntesis Ziegler-Alfol) es el fundamento de dos procesos comerciales, uno conocido como proceso Conoco (Conoco y Deutsche Texaco) que produce alcoholes entre C2-C28, prácticamente lineales en un 100%, empleando una temperatura lo más baja posible, y otro conocido como proceso Ethyl Corporation que produce predominantemente alcoholes entre C12-C14, lineales en un 95%.
Comparación de la composición de las mezclas de alcoholes del proceso Ziegler.
|
Nº átomos de carbono |
Proceso Conoco |
Proceso Ethyl Corporation |
|
6 |
9,6% |
1,4% |
|
8 |
16,9% |
3,2% |
|
10 |
20,7% |
7,7% |
|
12 |
19,4% |
34,5% |
|
14 |
15,1% |
26,3% |
|
16 |
9,8% |
16,7% |
|
18 |
5,3% |
8,9% |
|
20 |
3,2% |
1,3% |
Oxidación de hidrocarburos saturados4
La oxidación de los hidrocarburos alifáticos con aire en presencia de ácido metabórico, HBO2, (oxidación de Bashkirov) produce ésteres de ácido bórico con un alto rendimiento. Estos se hidrolizan en un segundo paso a alcoholes secundarios en los que los grupos hidroxilo se distribuyen estadísticamente a lo largo de la cadena molecular.
Normalmente, se utiliza como producto de partida una mezcla de n-hidrocarburos con longitudes de cadena entre 10 y 16 átomos de carbono. La oxidación se lleva a cabo en la fase líquida a 150-170 °C en presencia de 4-5% en peso de ácido metabórico empleando una mezcla de nitrógeno y oxígeno (con aproximadamente un 3,5% de O2), a presión normal o ligeramente elevada.
El producto de partida y los subproductos de oxidación se eliminan mediante evaporación instantánea y se limpian mediante lavadores de gases alcalinos y de agua. Los ésteres de ácido metabórico en el fondo de la columna de evaporación instantánea se hidrolizan mediante la adición de pequeñas cantidades de agua a 80- 00 °C. Después de la destilación fraccionada, se obtienen alcoholes con una pureza superior al 98%. El procesado finaliza con una hidrogenación sobre catalizadores heterogéneos de níquel para eliminar las sustancias coloreadas y olorosas.
Por ejemplo, la oxidación por este método del ciclohexano permite obtener una mezcla de ciclohexanol y ciclohexanona conocida como aceite KA. El ciclohexano que se obtiene en su mayor parte por hidrogenación del benceno es oxidado en fase líquida con aire en presencia de catalizadores solubles de cobalto o ácido bórico para producir una mezcla de ciclohexanol y de ciclohexanona (aceite KA). El ciclohexanol puede ser oxidado a ciclohexanona, que se usa para producir caprolactama, un monómero para la producción de nylon-6 (policaprolactama). El aceite de KA puede convertirse en ácido adípico y hexametilendiamina, los monómeros para la producción de nylon 66 (poli-hexametilenadipamida).
Hidratación de olefinas (alcoholes de C2 a C4)4
Un método común para la producción de alcoholes inferiores es la hidratación de alquenos. La hidratación de alquenos es Markovnikov, es decir, el protón se adiciona al carbono menos sustituido del alqueno (carbono con más hidrógenos) de modo que se obtienen alcoholes secundarios y terciarios (excepto en el caso del etileno):
El mecanismo transcurre con formación de un carbocatión intermedio, y la velocidad de la reacción viene determinada por la estabilidad de dicho carbocatión (terciario> secundario> primario). Por ello, la hidratación del isobuteno se produce a temperatura ambiente en presencia de bajas concentraciones de protones debido a la relativa estabilidad del carbocatión terciario intermedio, mientras que la hidratación del etileno requiere temperaturas y presiones elevadas.
La hidratación se emplea para la preparación de etanol a partir de etileno y de alcohol isopropílico a partir de propeno. También se emplea en la producción de 2-butanol a partir de una mezcla de 1-buteno y 2-buteno (raffinato II) y de alcohol terc-butílico (2-metil-2-propanol) a partir de isobuteno (isobutileno ó 2-metilpropeno).
Homologación de alcoholes4
Una reacción de homologación, también conocida como «homologización», es cualquier reacción química que convierte el reactivo en el siguiente miembro de la serie homóloga. Una serie homóloga es un grupo de sustancias químicas similares que difieren entre sí en un átomo de carbono, generalmente un grupo -CH2-.
La homologación de alcoholes es la reacción de alcoholes con gas de síntesis en presencia de complejos sistemas catalíticos multicomponentes. Dependiendo de las condiciones de reacción, los productos resultantes son aldehídos o alcoholes que contienen un grupo -CH2– más que los materiales de partida:
Aunque la reacción se concibió originalmente para la síntesis de etanol a partir de metanol, el alcance se ha ampliado para incluir la producción de aldehídos homólogos (acetaldehído a partir de metanol), ácidos carboxílicos (ácido propiónico a partir de ácido acético), ésteres de ácidos carboxílicos (acetato de etilo a partir de acetato de metilo), así como la síntesis de estireno (mediante la homologación de alcohol bencílico a 2-feniletanol con posterior deshidratación).
El proceso no goza de gran utilización industrial porque la conversión y la selectividad, a pesar de los considerables avances, todavía son insuficientes y porque existen problemas con el reciclaje de los complejos catalizadores de homologación.
Hidrocarbonilación mediante el proceso Reppe4
La hidrocarbonilación de olefinas mediante el proceso Reppe (en honor al químico alemán Walter Reppe) con monóxido de carbono y agua, y el uso de sales amónicas del dihidruro tetracarbonilo de hierro (H2Fe(CO)4) como catalizador, conduce a alcoholes con un átomo de carbono adicional. Al igual que en la oxosíntesis, también se forman productos de cadena ramificada (la relación molar de alcoholes de cadena lineal a ramificada es de aproximadamente 9:1).
El propeno reacciona a 90-110 °C y 5-20 bar para formar butanoles con rendimientos del 90%. Aproximadamente el 4% del propeno se hidrogena a propano.
La conversión de olefinas superiores requiere condiciones más extremas. El proceso no puede competir con la hidroformilación.
Hidrocarboximetilación4
La hidrocarboximetilación es una variante del proceso Reppe en el que las olefinas superiores reaccionan con monóxido de carbono y metanol en presencia de un catalizador de cobalto-piridina. Los productos son ésteres de ácidos carboxílicos que contienen un átomo de carbono más en la cadena madre que la materia prima olefínica. Los ésteres se pueden hidrogenar a los alcoholes. Puesto que estos productos pueden prepararse de manera más económica a partir de materias primas naturales, el proceso apenas tiene ahora importancia industrial.
Procesos de fermentación (alcoholes de C2 a C5)4
La fermentación, que es probablemente el proceso más antiguo para la fabricación de etanol, todavía se practica a gran escala. La fermentación de butanolacetona de las materias primas de carbohidratos ya no tiene importancia. En pequeña escala, los pentanoles se recuperan de los aceites de fusel (mezcla de alcoholes alifáticos de longitud de cadena C3, C4 y C5, en proporciones que varían según la procedencia. Normalmente contiene 2-metil-1-butanol, 3-metil-1-butanol (alcohol isoamílico), 2-metil-1-propanol (alcohol isobutílico) y n-propanol, en un medio etanólico).
Proceso Guerbet4
En el proceso Guerbet, los alcoholes primarios saturados se dimerizan en alcoholes primarios ramificados en posición a. Normalmente, la reacción se lleva a cabo con el alcohol a reflujo en presencia de un agente de condensación alcalino y un catalizador de hidrogenación-deshidrogenación, por ejemplo:
El agua y las pequeñas cantidades de hidrógeno producidas en la reacción se eliminan en continuo. Si el calentamiento se prolonga durante mucho tiempo también se forman alcoholes primarios a-ramificados triméricos.
El rendimiento de alcoholes diméricos es de aproximadamente el 80%. Se puede aumentar mediante el reciclaje de los residuos y la adición en porciones de catalizador nuevo. El sodio metálico, así como otras sustancias, se han propuesto como agentes de condensación. Para fines industriales, se prefieren los hidróxidos de metales alcalinos.
Debido a que los alcoholes con la típica ramificación en posición a se preparan más fácilmente por otros métodos, por ejemplo, el 2-etil-1-hexanol por hidroformilación de propeno para dar butanal y posterior condensación de aldol, la reacción de Guerbet no se ha establecido como un proceso industrial a gran escala.
Conclusión
- No todos los alcoholes son iguales, pues algunos, muy pocos, están incluidos en las Listas incluidas en el Anexo sobre sustancias químicas de la CAQ o en la Lista del Rrupo Australia, mientras que la mayoría de los alcoholes no están incluídos en Lista alguna.
- Sin embargo la CAQ incluye la exigencia de destruir la cantidad estequiométrica de un alcohol, calculada a partir de la relación efectiva de peso de los componentes en el tipo pertinente de munición química binaria/dispositivo químico binario.
- A la hora de preparar un agente químico de guerra mediante un proceso de síntesis a partir de un alcohol es probable que además de la toxicidad del producto final se tenga muy en cuenta la disponibilidad y pureza del alcohol a emplear en la síntesis, sobre todo cuando lo que prima son los efectos psicológicos sobre los efectos letales de la dispersión de un agente neurotóxico.
Referencias
- «Convención sobre la Prohibición del Desarrollo, la Producción, el Almacenamiento y el Empleo de Armas Químicas y sobre su Destrucción», https://www.opcw.org/sites/default/files/documents/2019/02/CWC_es.pdf
- «Grupo Australia», https://australiagroup.net/es/listas.html
- «Fluorine chemistry at the millennium-fascinated by fluorine», R.E. Banks, Elsevier Science Ltd., 2000
- «Ullmann’s Encyclopedia of Industrial Chemistry», «Alcoholes alifáticos», 7th ed, Wiley-VCH (Editor), 2011
- «Química orgánica», I.L. Finar, Ed. Alhambra, 3ª ed., 1975
- «Química orgánica superior», L.F.Fieser & M. Fieser, Ed. Grigalbo, 1966
- «Química orgánica», N.L. Allinger y otros, Ed. Reverté, 1973
- «Reacciones de síntesis de alcoholes», https://www.google.com/url?sa=t&rct=j&q=&esrc=s&source=web&cd=1&ved=2ahUKEwi71YHJtsjhAhUp8uAKHT98DVQQFjAAegQIARAC&url=https%3A%2F%2Fwww2.ulpgc.es%2Fhege%2Falmacen%2Fdownload%2F4%2F4545%2FReacciones_de_los_Alcoholes.doc&usg=AOvVaw2sYf0-92GWbgom2704PDWq
- «Oxo alcohols», Wikipedia, https://en.wikipedia.org/wiki/Oxo_alcohol