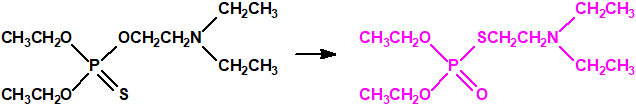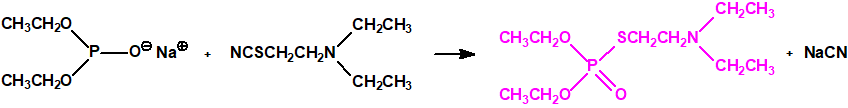Introducción1
Las plagas han sido desde tiempos inmemoriales un problema para la agricultura. Los fósiles confirman la presencia de moscas que preceden a los humanos en este mundo. El primer ejemplo de control de plagas se remonta a la época en que un ser humano mató por primera vez a un mosquito o aplastó una mosca molesta. Desde que los humanos se dedicaron a la agricultura, se dieron cuenta de los peligros de las plagas para los cultivos alimentarios, y comenzaron a idear formas de repeler esas criaturas dañinas. Casi todas las civilizaciones han empleado métodos químicos o biológicos como medidas para el control de plagas, por ejemplo, los antiguos sumerios que usaron compuestos de azufre para matar insectos y en el 1200 a.C., los chinos emplearon hormigas depredadoras contra las plagas de escarabajos y orugas.
En la época medieval la ignorancia y la superstición llevaron a considerar las plagas como un castigo de Dios, y la lucha contra las mismas decayó. No fue hasta el Renacimiento, con el despertar científico, cuando el control de plagas volvió a cobrar fuerza, y se emplearon sustancias orgánicas e inorgánicas, como por ejemplo, la nicotina y el arsénico, para combatir diversas plagas de insectos.
El uso de pesticidas para combatir las plagas progresó notablemente gracias al descubrimiento, a finales del siglo XIX, de algunos insecticidas sintéticos, como por ejemplo, el DDT, y a la búsqueda, a principios del siglo XX, de nuevos pesticidas, que condujo al desarrollo de los pesticidas organofosforados y al descubrimiento de los agentes neurotóxicos de guerra.
Pero nuestra historia comienza en los años 1900 con el aprovechamiento de las propiedades insecticidas del jabón.
Del jabón a los pesticidas2,3
El jabón líquido o fácilmente soluble (soft soap), generalmente elaborado por saponificación de los ácidos grasos con hidróxido potásico resultó ser muy efectivo como insecticida y acaricida para combatir el pulgón, la cochinilla, la mosca blanca, los trips y la araña roja, entre otros, en diferentes tipos de plantaciones, por ejemplo, en las de lúpulo. El jabón potásico es biodegradable e inocuo, actúa por contacto reblandeciendo la cutícula protectora de los insectos, provocando su asfixia, sin dañar a otros insectos beneficiosos como las abejas o sus propios predadores naturales, útiles también para controlar la plaga. Además es una fuente de potasio para las plantas.
En 1912, uno de los principales productores de jabón en Reino Unido, la empresa Chiswick Polish Co. Ltd., percibió en ello una oportunidad de desarrollo, y compró un terreno en Yalding una localidad situada en el condado de Kent, en Inglaterra, que estaba bien comunicado por carretera, ferrocarril y río, para levantar en él una fábrica para la producción jabón potásico.
Poco después, en 1914, Chiswick Polish Co. Ltd. fue vendida a un consorcio compuesto principalmente por productores locales de fruta y lúpulo, y pasó a llamarse Yalding Manufacturing Co. Ltd.. Continuó con la fabricación de su conocida marca de jabón potásico, pero extendió su gama de producción para incluir otras actividades como el lavado de fruta y lúpulo, los fungicidas y los insecticidas.
Tras el descubrimiento por parte del profesor Ian McDougall, de McDougall Bros de Manchester, de las propiedades insecticidas del tubli (Derris elliptica, una especie de árbol del género Derris, originario de la India), la fábrica de Yalding Manufacturing Co. Ltd. se fusionó con McDougall Bros, en 1921, para convertirse en McDougall & Yalding Ltd..
Tras el descubrimiento en 1885 del poder fungicida de los compuestos de cobre (Mezcla Bordeaux, sulfato de cobre, hidróxido de calcio y agua) muchas empresas se interesaron por la protección de los cultivos, y en 1927, McDougall & Robertson, William Cooper & Nephews, McDougall & Yalding Ltd., Tomlinson & Hayward Ltd., y Abol Ltd. se fusionaron para formar Cooper, McDougall & Robertson Ltd..
En los años siguientes, la empresa ICI (Imperial Chemical Industries) empezó a interesarse por el desarrollo de nuevos productos químicos para la protección de cultivos, en competencia con la empresa Cooper, McDougall & Robertson. Para poner fin a esta competencia, en junio de 1937 crearon una nueva empresa Plant Protection Ltd., y la fábrica de Yalding quedó primero bajo el control de la División de Colorantes de ICI (ICI Dyestuffs Division), para pasar finalmente a la División de Productos Químicos Generales de ICI (ICI General Chemicals Division). En 1964, ICI decidió fusionar sus intereses de producción y protección de cultivos, y Plant Protection Ltd. pasó a formar parte de la División Agrícola de ICI. Finalmente, en 1987, tras la adquisición de Stauffer Chemical Company, y de acuerdo con la campaña de imagen corporativa de ICI, el nombre Plant Protection desapareció, y la empresa pasó a operar globalmente como ICI Agrochemicals. En junio de 1993, ICI escindió sus negocios, y los productos farmacéuticos, agroquímicos, semillas y productos biológicos se transfirieron a una empresa nueva e independiente llamada Zeneca, que posteriormente se fusionó, en 1999, con Astra AB para formar AstraZeneca.
La empresa Plant Protection Ltd, creada en 1937, subsidiaria de ICI y de Cooper, McDougall & Robertson, realizó hasta su desaparición importantes descubrimientos, destacando entre ellos el amitón, un poderoso pesticida que condujo al desarrollo del famoso agente neurotóxico VX.
PPL (Plant Protection Limited) y el amitón4,5
Después de la Segunda Guerra Mundial, las industrias de pesticidas e insecticidas se expandieron rápidamente, y muchas compañías comenzaron a trabajar en compuestos organofosforados. Entre 1952 y 1953, al menos tres empresas (Geigy, ICI y Sandoz)6 identificaron un grupo de ésteres organofosforados (con un grupo –S-2-dialquilaminoetilo), con una potente actividad insecticida, especialmente contra los ácaros. Después de que estas sustancias fueran patentadas, y sus propiedades publicadas en la literatura abierta, algunas de ellas se comercializaron como insecticidas6:
- «Process for the production of basic thiophosphoric or dithiophosphoric acid esters», J. R. Geigy, AG., British patent no. 740563 (app. March 1952).
- «New basic esters of phosphorus containing acids», R. Ghosh, (I.C.I. Ltd.), British patent no. 738839 (app. November 1952).
- «Pest control agents», Sandoz Ltd., British patent no. 781471 (app. May 1953).
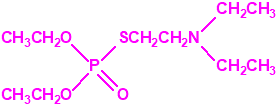
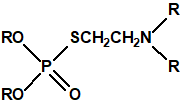
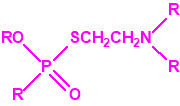
Una de estas sustancias fue un candidato a acaricida, que recibió el nombre de amitón (O,O-diethyl-S-2-diethylaminoethyl phosphorothiolate), descubierto por los químicos Ranajit Ghosh y J. F. Newman, que trabajaban en la Plant Protection Limited (PPL) en Yalding, Kent. Recordemos que PPL era una compañía subsidiaria de ICI y de Cooper, McDougall & Robertson (CMR), creada en 1937 para poner fin a la competencia entre ambas en la producción de pesticidas. Ghosh probablemente sintetizó el amitón a principios de 1952, aunque hay quien afirma que fue sintetizado en 19487. PPL no solicitó la patente sobre el compuesto hasta noviembre de 1952, y los detalles acerca del amitón no se publicaron hasta 1955, cuando éste ya estaba protegido por varias patentes que cubrían su método de síntesis:
- «New Basic Esters of Phosphorus-Containing Acids», Ranajit Ghosh, British Patent Number 738839, Application Date: November 19, 1952.
- «Manufacture of Basic Esters of Phosphorothiolic Acid», Ranajit Ghosh, British Patent Number 763516, Application Date: July 16, 1954.
- «New Pesticidal Basic Esters of Phosphorothiolothionic Acid», Ranajit Ghosh, British Patent Number 763516 Application Date: July 16, 1954.
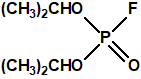
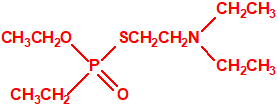
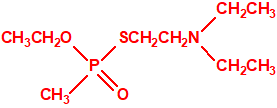
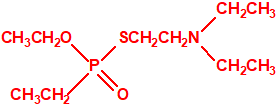
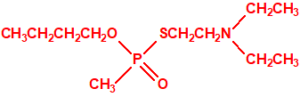
Estructura del amitón (también conocido como C-11, VG, T-2274, R-5158 ó EA 1508), fosforotiolato de O,O-dietilo y S-2-dietilaminoetilo
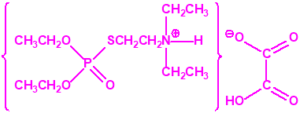
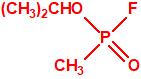
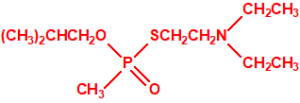
En 1954, ICI comercializó como insecticida una forma del amitón (la sal de hidrógeno oxalato) con el nombre comercial Tetram®. Tres años más tarde, Nature informó que PPL estaba fabricando un «nuevo» pesticida con los nombres comerciales Tetram® e «ICI Amitón», que tenía una alta toxicidad para el hombre, pero un gran poder insecticida, en gran medida específico para la araña roja y otros ácaros, y para los insectos escamosos, y que tenía poco efecto sobre los depredadores de insectos8.
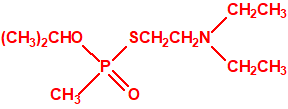
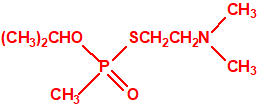
Tetram (hidrógeno oxalato de fosforotiolato de O,O-dietilo y S-2-dietilaminoetilo)9
Para la síntesis del amitón se utilizan métodos que parten de fosforotiono derivados que finalmente por isomerización conducen al amitón10:
Otra ruta para su síntesis es la reacción del dietilfosfito de sodio con el tiocianato de 2-dietilaminoetilo:
El amitón no tuvo el éxito esperado como insecticida. No solo era altamente tóxico para los humanos, sino que se absorbía fácilmente a través de la piel hacia el torrente sanguíneo, lo que le hacía demasiado peligroso para el uso agrícola. Todo indica que pese a ser un excelente insecticida sistémico contra artrópodos succionadores, como los ácaros y los insectos escamosos, y pese a la ausencia de accidentes durante sus ensayos, la toxicidad intrínseca del material (su LD50 oral en ratas es ~ 3 mg/kg)7 resultaba demasiado elevada como para permitir su explotación comercial, y en consecuencia, el producto fue retirado del mercado allá por el año 19586. Una elevada toxicidad percutánea no es una buena cualidad para un buen insecticida, pero en cambio si lo es para un buen agente químico de guerra.
De tal palo tal astilla4,5,6
Los compuestos del tipo «amitón» rápidamente atrajeron la atención de los laboratorios militares, por la mayor toxicidad que llevaba la introducción de un átomo de nitrógeno básico en la molécula del compuesto organofosforado, efecto que provocó un considerable interés en las teorías sobre la inhibición de la colinesterasa que en ese momento se estaban desarrollando.
Varios grupos de investigación, entre ellos un equipo del Instituto I. M. Sechenov de Leningrado, que en 1955 habían empezado a estudiar diversos compuestos similares al amitón, habían vaticinado un aumento de la actividad inhibidora de la colinesterasa para este tipo de compuestos11.
Ya que los compuestos del tipo del sarín (alquilfosfonofluoridatos de O-alquilo) habían mostrado poseer una mayor actividad inhibidora que los fluorofosfatos de O,O’-dialquilo, posiblemente debido a la presencia de una cadena alquílica unida directamente al átomo de fósforo, parecía un desarrollo lógico en el estudio del potencial tóxico de la cadena S-2-dialquilaminoetilo, pasar de las estructuras del tipo «fosforotiolatos de O,O’-dialquilo», como las de los análogos del amitón, a las estructuras del tipo «alquilfosfonotiolatos de O-alquilo»:
|
Fluorofosfato de O,O-diisopropilo, DFP |
Metilfosfonofluoridato de O-isopropilo, sarín |
|
fosforotiolatos de dialquilo |
alquilfosfonotiolatos de alquilo |
|
amitón, VG fosforotiolato de O,O-dietilo y S-2-dietilaminoetilo |
VE etilfosfonotiolato de O-etilo y S-2-dietilaminoetilo |
En 1954 diversos investigadores de los campos académico, industrial y militar dieron este paso, casi al mismo tiempo12:
- Ranajit Ghosh y J. F. Newman de la empresa ICI publicaron un artículo («A New Group of Organophosphate Pesticides», Chemistry and Industry, 1955, 118) que daba detalles de esta clase de compuestos;
- El químico alemán Gerhard Schrader y su equipo preparaban el metilfosfonotiolato de O-isopropilo y de S-2-dietilaminoetilo, en la Farbenfabriken Bayer AG:
- El químico sueco Lars-Erik Tammelin preparaba el metilfosfonotiolato de O-etilo y de S-2-dietilaminoetilo (VM), y el metilfosfonotiolato de O-isopropilo y de S-2-dimetilaminoetilo, en el Laboratorio de Defensa de Guerra Química del gobierno sueco:
VM
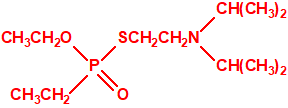
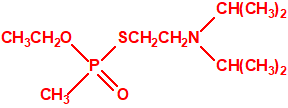
- Ranajit Ghosh en la empresa ICI preparaba el etilfosfonotiolato de O-etilo y de S-2-dietilaminoetilo (VE), sobre el cual se presentó una solicitud de patente a su debido tiempo («New basic ester of thiophosphonic acids and salts thereof», Rajanit Ghosh, ICI Ltd., British patent no. 797603, applied June 1955), que posteriormente interfirió con una solicitud de patente realizada por el G. Schrader («Phosphonic acid esters», K. Schegk, H. Schlar & G. Schrader, Farbenfabriken Bayer AG., British patent no. 847550, applied June 1957). Al igual que sucedía con el amitón, este compuesto tenía una poderosa acción acaricida, pero era aún más tóxico para los mamíferos. Cuando se concedió la patente sobre este nuevo compuesto y sus congéneres, el amitón ya había sido retirado del mercado debido a su peligrosa toxicidad para el hombre, especialmente a través de la piel:
VE
PPL informó, a través de su empresa matriz ICI, de la existencia del amitón al Establecimiento Experimental de Defensa Química (Chemical Defence Experimental Establishment, CDEE) en Porton Down muy probablemente a finales de 1952 o principios de 1953.
La solicitud de colaboración a la industria solicitada en 1951 por el gobierno británico a través del Ministerio de Abastecimiento y Porton Down había generado poco interés, así que antes de reiterar de nuevo la solicitud de colaboración a la industria en 1953, para asegurar la confidencialidad, el Ministerio de Abastecimiento estableció un sistema de códigos comerciales («C-xx») para identificar a cada compuesto antes de su remisión a Porton Down para su estudio. El primer compuesto tratado bajo el nuevo sistema, el compuesto R-5158, recibió el código C-11.
Una vez que el C-11 (el amitón), fue transferido a Porton Down, recibió el nombre, en clave militar, de VG. La «V» aparentemente significaba «venomous» («venenoso») debido a su toxicidad por contacto con la piel. Los miembros de la Junta Asesora de Defensa Química observaron que C-11 (T-2274) y otro compuesto similar designado T-2290, que más tarde recibiría el nombre en clave de agente VE, eran «con mucho» los compuestos más peligrosos por contacto con la piel desnuda. Por lo tanto, a finales de 1953, Porton Down ya era consciente de las propiedades tóxicas del agente VE, que aunque tenía importantes propiedades insecticidas, resultaba para los mamíferos aún más tóxico que el propio VG (amitón). Como resultado, el VE reemplazó al VG como candidato a agente químico de guerra. PPL continuó sus trabajos de desarrollo en esta área y, en junio de 1955, Ghosh solicitó una patente sobre el VE. Lo que no está claro es si los científicos militares del CDEE sintetizaron el VE de forma independiente modificando el VG (amitón), o si PPL descubrió el VE y lo transfirió a Porton Down . Posteriormente, los científicos de Porton identificaron sustancias que eran aún más tóxicas que VE al hacer modificaciones en la estructura molecular del VG.
Los documentos disponibles dejan sin respuesta muchas preguntas importantes acerca de la transferencia de tecnología de la industria civil a la industria militar. Existen ambigüedades con respecto a cuánta información sobre el amitón y el agente VE fue transferida por PPL a Porton Down, y cuánta información adquirió Porton Down por sí mismo. Todo lo que se puede afirmar con certeza es que el uso de la sustancia química C-11 se transfirió de PPL a Porton Down en algún momento entre 1951 y 1953, muy probablemente a finales de 1952 o principios de 1953.
En mayo de 1954, en virtud del acuerdo tripartito de 1936, el gobierno británico pasó la información sobre el VG (amitón) y el VE, constituyentes de lo que habían denominado serie C11, a los científicos aliados del Arsenal Edgewood (Edgewood Arsenal) de los Estados Unidos, y de la Estación Experimental en Suffield (Suffield Experimental Station) de Canadá.
En julio de 1956, los científicos militares del Arsenal Edgewood habían sintetizado aproximadamente cincuenta agentes nerviosos de la serie V, incluidos los denominados con los códigos «VE», «VG», «VM», «VP», «VR», «VS» y «VX», y los estudió detalladamente para obtener la mejor combinación de características militarmente deseables, tales como toxicidad, estabilidad en almacenamiento, persistencia en el campo de batalla y facilidad de fabricación. En febrero de 1957, el Comando de Investigación y Desarrollo del Ejército (Army Research and Development Command) seleccionó el VX como el agente de «tipo V» (persistente) en el que concentrar el trabajo adicional, incluido el desarrollo de plantas piloto de producción y estudios acerca de su diseminación. El VX, a diferencia de los agentes de la serie G, es un líquido poco volátil y, por tanto, muy persistente en la zona en la que es utilizado. Además, se comprobó que el VX aplicado en piel era unas cien veces más tóxico que el sarín y unas dos veces más tóxico que éste por vía inhalatoria13,14.
La estructura química exacta del VX era un secreto militar. En 1957, los servicios de inteligencia de la Unión Soviética obtuvieron información detallada de los agentes neurotóxicos de la serie V, y en los años sesenta desarrollaron un agente similar, conocido como RVX, VX soviético (ruso), R-33 o agente 33. En diciembre de 1972 dio comienzo la producción de VX ruso a gran escala en Novocheboksarsk (Chuvashia), que finalizaría en 198713,14.
La explicación habitual de las discrepancias entre el VX occidental y el VX ruso, es que la inteligencia militar soviética había obtenido la fórmula empírica, C11H26NO2PS, del agente VX estadounidense pero no su estructura química, lo que llevó a los químicos soviéticos a una estructura química similar pero no idéntica a la del VX13:
|
VX |
RVX, R-33 |
Otra hipótesis más probable es que los soviéticos conocían la estructura química correcta del VX, pero eran incapaces de fabricarlo con la tecnología química de que disponían y optaron por sintetizar una variante estructural de VX utilizando un método diferente. Una tercera hipótesis es que los soviéticos desarrollaron deliberadamente un análogo del VX en la creencia de que los sistemas de detección desarrollados para el agente VX no detectarían el R-33. Los estudios toxicológicos llevados a cabo más tarde concluyeron que el VX soviético, inhibía la acetilcolinesterasa de manera irreversible y mucho más rápida que el VX occidental, lo que le haría más letal que éste último13.
Referencias
- «The History Of Pest Control», Ameri-Tech, https://ameritechpest.com/the-history-of-pest-control.html
- «Chiswick Soft Soap and Polish Company – (former) ICI Yalding site», http://wikimapia.org/29746085/Chiswick-Soft-Soap-and-Polish-Company-former-ICI-Yalding-site
- «Report – Yalding Agrochemical Laboratory – Update – Nov 2019», https://www.28dayslater.co.uk/threads/yalding-agrochemical-laboratory-update-nov-2019.120767/
- «Double-Edged Innovations-Preventing the Misuse of Emerging BC Technologies»-Jonathan B. Tucker, Defense Threat Reduction Agency, 2010, https://apps.dtic.mil/dtic/tr/fulltext/u2/a556984.pdf
- «Innovation, Dual Use, and Security-Managing the Risks of Emerging Biological and Chemical Technologies», Jonathan B. Tucker, The MIT Press, 2012.
- «The problem of Chemical and Biological Warfare», Volume I. The Rise of CB Weapons, «V-Agent Nerve Gases», Julian Perry Robinson, SIPRI, 1971.
- «Chemistry of Organophosphate Pesticides», C. Fest & K.-J. Schmidt, Springer-Verlag, 1982.
- «A New Organophosphorus Insecticide», Nature, 179, 763 (1957)
- «The Acute and Subacute Toxicity of Technical O,O-Diethyl S-2-Diethylaminoethyl Phosphorothioate Hydrogen Oxalate (Tetram)», C. Boyd Shaffer & Bob West, Toxicology and Applied Pharmacology 2, 1-13 (1960)
- «The Preparation and Isomerization of Some Basic Esters of O,O’-Diethyl Hydrogen Phosphorothioate», A. Calderbank & R. Ghosh, Chem. Soc., 1960, 637-642
- «On the physiological activity of the organophosphorus compounds», E. V. Zeymal, M. Y. Mikhel’son & N. K. Fruyentov, Second conference on the chemistry and use of organic phosphorus compounds, USSR Academy of Sciences, Kazan, 1959.
- «A Short History of the Development of Nerve Gases», https://web.archive.org/web/20061112085443/http:/www.mitretek.org/AShortHistoryOfTheDevelopmentOfNerveGases.htm
- «War of Nerves, Chemical Warfare from WWI to Al-qaeda», Jonathan B. Tucker, Pantheon Books, 2006
- «Armas químicas: La ciencia en manos del mal», René Pita Pita, Plaza y Valdés Editores, 2008