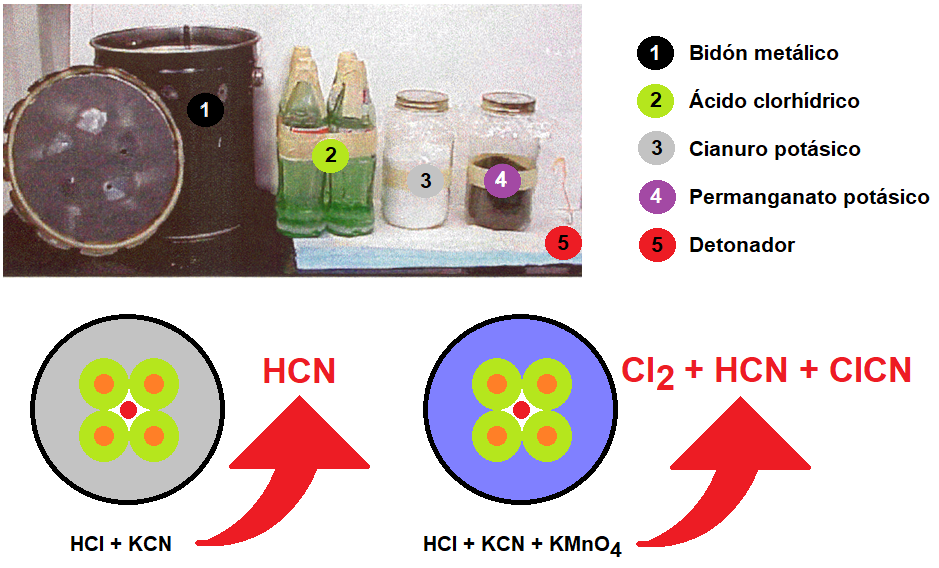
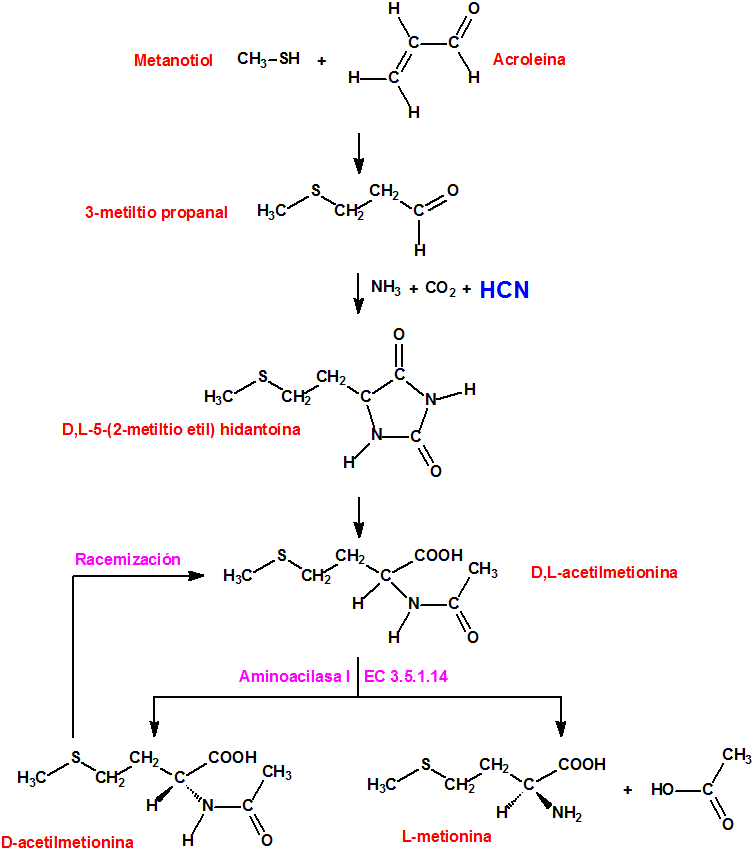
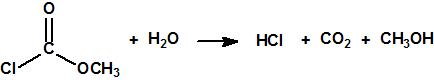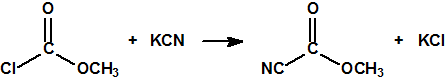Mubtakkar es una palabra árabe que se traduce al inglés como «invención», «iniciativa» o «inventiva». La palabra fue utilizada al parecer por Al-Qaeda para describir un artefacto químico improvisado, desarrollado y diseñado liberar gases tóxicos, y utilizarse en un ataque en el metro de la ciudad de Nueva York1,2,3. Según indica el escritor Ron Suskind, en su libro «The one percent doctrine: deep inside America’s pursuit of its enemies since 9/11«, el plan para este ataque fue cancelado, a sólo cuarenta y cinco días del ataque, por el líder de Al-Qaeda, Ayman al-Zawahiri4.
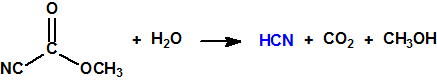
El mubtakkar se describe como un pequeño dispositivo químico binario capaz de generar grandes cantidades de cianuro de hidrógeno gaseoso, con la finalidad de matar a numerosas personas en un espacio cerrado. Los componentes de este dispositivo químico binario, contenidos en dos envases separados, no serían peligrosos como tales por lo que el dispositivo y sus componentes se podrían almacenar, montar y transportar con poco riesgo para los autores. Cuando los dos componentes, una sal apropiada de cianuro (por ejemplo, cianuro potásico) se pone en contacto con un ácido fuerte (por ejemplo ácido clorhídrico) se produce ácido cianhídrico que se evapora fácilmente. La inclusión de un tercer componente, permanganato potásico, tendría como finalidad, como veremos más adelante, conseguir una mezcla de gases, cloro, cloruro de cianógeno y cianuro de hidrógeno, todos ellos tóxicos por inhalación1,2,3.
Foto y esquema del mubtakkar mostrando los componentes y los productos generados
Cianuro de hidrógeno y cloruro de cianógeno, agentes químicos de guerra
Al comienzo de la Primera Guerra Mundial (WWI), tras el empleo inicial de agentes lacrimógenos, los principales agentes químicos de guerra eran el cloro y el fosgeno, que dañaban los pulmones y estaban clasificados como agentes sofocantes (lung damaging o “choking” agents)5.
Iniciada la guerra química los franceses estudiaron el posible empleo del cianuro de hidrógeno, conocido por las siglas AC, tal vez porque estaba fácilmente disponible en la industria química francesa2,5. El cianuro de hidrógeno (CAS 74-90-8), también denominado ácido cianhídrico, es un gas por encima de los 25,6 ºC, por lo que la inhalación es la principal vía de entrada en el organismo2.
El comandante británico Victor Lefebure oficial de enlace químico con los franceses durante la Primera Guerra Mundial, describía los efectos del ácido cianhídrico como del tipo «todo o nada», es decir, o el combatiente moría, o se recuperaba rápidamente sin ningún tipo de secuelas. En los casos graves, segundos después de la exposición, se producían hiperapnea y convulsiones, seguidas de paro cardiorrespiratorio2.
Los agentes cianurados se suelen denominar agentes «hemotóxicos» o «sanguíneos», para diferenciarlos de los «sofocantes» o «pulmonares», lo que induce muchas veces al error de creer que actúan en la sangre. Los agentes cianurados, una vez inhalados, se absorben a través de los pulmones y son transportados por la sangre hasta las células del organismo, donde impiden el uso del oxígeno (respiración celular) y provocan la muerte celular. Es en las células, por tanto, donde ejercen su acción2.
Los principales inconvenientes para el empleo del ácido cianhídrico en el campo de batalla son, por un lado la densidad de sus vapores, inferior a la del aire, lo que hace que sea poco persistente y, por otro lado, su baja estabilidad térmica, que facilita su destrucción por el efecto térmico de la explosión de las municiones. Aún así los franceses eran fervientes partidarios del empleo de proyectiles con cianuro de hidrógeno pues pensaban que las máscaras de protección alemanas de aquel entonces no eran capaces de retenerlo2.
El 1 de julio de 1916 los franceses emplearon en la Batalla del Somme «proyectiles especiales nº 4» cargados con cianuro de hidrógeno, pero el resultado no fue el esperado, ya que los alemanes sabedores de que los franceses disponían de este tipo de proyectiles, habían dotado a sus tropas con cartuchos filtrantes con óxido de plata, que impedía el paso del cianuro de hidrógeno2:
2 ↑HCN + Ag2O → 2 ↓AgCN + H2O
El ácido cianhídrico empleado en los proyectiles franceses era una mezcla denominada Vincennite6,7, porque se había probado por primera vez en la localidad francesa de Vincennes. La vincennite contenía un 50% de HCN, un 30% de AsCl3, un 15% de SnCl4 y un 5% de CH3Cl3. El tricloruro de arsénico y el tetracloruro de estaño tenían como finalidad aumentar la densidad de los vapores y disminuir su volatilidad, y el cloroformo evitar la posible polimerización del cianuro de hidrógeno. Más tarde utilizarían una nueva mezcla, denominada Manganite6,7, que contenía un 50% de HCN y un 50% de AsCl3, que tampoco conseguiría solucionar el problema de la persistencia2.
Aun así, se estima que durante la Primera Guerra Mundial los franceses emplearon unas 4000 tm de cianuro de hidrógeno2.
Los británicos opinaban, al igual que los alemanes, que el cianuro de hidrógeno no era una buena opción, aunque llegaron a crear una mezcla denominada Jellite, conocida con las siglas JL7, que consistía en una disolución al 50% de cianuro de hidrógeno en cloroformo, espesada con acetato de celulosa, pero ellos mismos reconocían que su baja persistencia en el campo de batalla hacía muy difícil obtener concentraciones letales2.
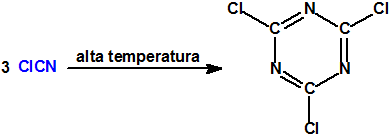
En la búsqueda de otras sustancias químicas cianuradas los austriacos introdujeron, en septiembre de 1916, el bromuro de cianógeno, conocido con las siglas CB, que resultó ser demasiado corrosivo para su almacenamiento, y los franceses empezaron a utilizar, en octubre de 1916, el cloruro de cianógeno (CAS 506-77-4), de vapores más densos que el aire, al que denominaban Mauguinite o Mauginite. Su principal inconveniente era su posible polimerización, así que se utilizaba en forma de mezcla, denominada Vitrite6,7, que contenía un 70% de ClCN y un 30% de AsCl3.2
Química y toxicidad del HCN y del ClCN
El cianuro de hidrógeno y el cloruro de cianógeno son moléculas pequeñas, de pequeño peso molecular, 27,03 g y 61,47 g, respectivamente, la primera con vapores menos densos que el aire (drel 0,948), de modo que flota en el aire, y la segunda con vapores más densos que el aire (drel 2,16) de modo que se hunde en el terreno. Ambas tienen puntos de ebullición muy próximos a los 20 °C, el cianuro de hidrógeno hierve a 25,6 °C, mientras que el cloruro de cianógeno lo hace a 12,8 °C. El cianuro de hidrógeno es inflamable con un LEL (límite inferior de explosividad) del 5,6% y un UEL (límite superior de explosividad) del 40%.
La reacción entre el cianuro potásico y el ácido clorhídrico es una reacción exotérmica muy sencilla que permite la liberación de cianuro de hidrógeno:
KCN + HCl → ↑HCN + KCl
Como puede apreciarse un mol de cianuro potásico reacciona con un mol de ácido clorhídrico y producen un mol de ácido cianhídrico y un mol de cloruro potásico. Puesto que el ácido clorhídrico suele presentarse en disolución acuosa al 33% (d=1,165 g/mL) para un kilogramo de cianuro potásico se necesitarían al menos 1,46 L de ácido clorhídrico al 33% para producir del orden de 344 L de cianuro de hidrógeno (alrededor de 415 gramos), que permitiría una concentración aproximada de 450 mg/m3 en un recinto de dimensiones 20 m × 20 m × 2,5 m (1000 m3).
Si además se añade permanganato potásico como oxidante, con el fin de oxidar el ácido clorhídrico a cloro, de modo que éste pueda reaccionar con el cianuro de hidrógeno y transformarlo en cloruro de cianógeno, podríamos tener las siguientes reacciones:
|
5 KCN + 5 HCl → 5 ↑HCN + 5 KCl 2 KMnO4 + 16 HCl → 5 ↑Cl2 + 2 MnCl2 + 2 KCl + 8 H2O 5 HCN + 5 Cl2 → 5 ↑ClCN + 5 HCl |
| 2 KMnO4 + 16 HCl + 5 KCN → 5 ↑ClCN + 2 MnCl2 + 7 KCl + 8 H2O |
O bien:
|
2 KMnO4 + 16 HCl → 5 ↑Cl2 + 2 MnCl2 + 2 KCl + 8 H2O 5 KCN + 5 ↑Cl2 → 5 ↑ClCN + 5 KCl |
| 2 KMnO4 + 16 HCl + 5 KCN → 5 ↑ClCN + 2 MnCl2 + 7 KCl + 8 H2O |
Dependiendo probablemente de diversos factores se obtendría sólo cloruro de cianógeno, o lo más probable, una mezcla de cianuro de hidrógeno, cloruro de cianógeno y cloro.
Puesto que las propiedades físico-químicas y las toxicidades del HCN y del ClCN no son exactamente iguales, sus efectos tampoco lo serán, así que dependiendo de las circunstancias pudiera ser preferible generar cianuro de hidrógeno o generar cloruro de cianógeno.
Para el HCN la LCt50 es del orden de 2500-5000 mg×min/m3 con una densidad relativa de sus vapores de 0,95 (menos denso que el aire), mientras que para el ClCN la LCt50 es del orden de 11 000 mg×min/m3 (es menos tóxico que el HCN) con una densidad relativa de sus vapores de 2,16 (más denso que el aire).
No todas las sales de cianuro liberan fácilmente cianuro de hidrógeno cuando se les añade un ácido fuerte. Por ejemplo, el ferrocianuro de potasio, K4Fe(CN)6, con un contenido de cianuro en peso del 47,41% y el ferricianuro de potasio, K3Fe(CN)6, con un contenido de cianuro en peso del 42,38% (el cianuro potásico tiene un contenido de cianuro en peso del 39,96%) apenas reaccionan, y no liberan cianuro de hidrógeno con facilidad. La adición de un ácido fuerte los transforma en los correspondientes ácidos, que acaban descomponiéndose, lentamente a temperatura ambiente, y más rápidamente por calentamiento, con liberación de cianuro de hidrógeno8:
K4Fe(CN)6 + 4 HCl → 4 KCl + H4Fe(CN)6
K3Fe(CN)6 + 3 HCl → 3 KCl + H3Fe(CN)6
3 H4Fe(CN)6 → 12 ↑HCN + Fe2[Fe(CN)6]
2 H3Fe(CN)6 → 6 ↑HCN + Fe[Fe(CN)6]
El sulfuro de hidrógeno, agente químico de guerra
Los británicos estudiaron el sulfuro de hidrógeno (CAS 7783-06-4), una sustancia no cianurada aunque con el mismo mecanismo de acción que éstas, pero que también presentaba importantes inconvenientes desde el punto de vista práctico, pues era muy inflamable, corroía las bombonas, licuaba a mayores presiones que el cloro (una Pcrit = 7977 kPa para el cloro frente a una Pcrit = 8960 kPa para el sulfuro de hidrógeno), y presentaba un olor característico, incluso a muy bajas concentraciones, lo que permitía una fácil detección por parte del enemigo. Aunque el sulfuro de hidrógeno es algo más denso que el aire (drel 1,19) para aumentar su densidad y su persistencia se probó a mezclarlo con cloropicrina (drel 5,7) en una mezcla denominada «estrella verde» (Green Star) 7 consistente en un 35 % de sulfuro de hidrógeno y un 65 % de cloropicrina, pero la corrosión que producía el sulfuro de hidrógeno rápidamente descartó esta iniciativa. No obstante el sulfuro de hidrógeno se utilizó en dos ocasiones, en 1916, mezclado con sulfuro de carbono al 10% para aumentar su densidad, una mezcla conocida como NG2 o «doble estrella roja» (Double Red Star) 7, que resultó ser más inflamable que el sulfuro de hidrógeno solo2.
Química y toxicidad del sulfuro de hidrógeno
El sulfuro de hidrógeno, H2S, también es una molécula pequeña, de peso molecular 34,08 g, gas en condiciones normales, con punto de ebullición de -60,6 °C y vapores ligeramente más densos que el aire (drel 1,19). El sulfuro de hidrógeno es inflamable con un LEL (límite inferior de explosividad) del 4,3 % y un UEL (límite superior de explosividad) del 46%.
El sulfuro de hidrógeno es un gas poco soluble en agua (una solución saturada de H2S a temperatura y presión ordinarias, alcanza solamente una concentración 0,12 M en H2S), y en solución acuosa se encuentra muy poco disociado por su carácter de electrólito débil (pKa1 = 7,05 y pKa2 = 12,92).
El sulfuro de hidrógeno se puede obtener de diversas maneras, bien por medio de alguna reacción química, bien a partir del gas natural, gases asociados y gases de refinería8:
- Mediante reacción del azufre elemental con hidrógeno:
↑H2 + ½ S2 → ↑H2S
Con hidrógeno de pureza 98% y azufre de pureza 99%, a 450 °C y 0,7 MPa de presión, se obtiene una mezcla con un 95% de sulfuro de hidrógeno, un 3% de hidrógeno y un 2% de impurezas diversas.
- Mediante reacción del azufre elemental con hidrocarburos:
CH4 + 2 S2 → 2 ↑H2S + CS2
CS2 + 2 H2O → 2 ↑H2S + CO2
La hidrólisis del sulfuro de carbono permite la producción de más sulfuro de hidrógeno.
- Mediante reducción de diferentes sulfuros metálicos:
MS + ↑H2 → ↑H2S + M
Se requieren temperaturas por encima de los 500 °C
- Mediante reacción de diferentes sulfuros metálicos con ácidos fuertes:
FeS + 2 HCl → FeCl2 + ↑H2S
Na2S + 2 HCl → 2 NaCl + ↑H2S
Sb2S3 + 6 HCl → 2 SbCl3 + 2 ↑H2S
La reacción del sulfuro ferroso con ácido clorhídrico se ha empleado durante mucho tiempo en los laboratorios químicos de análisis para generar ácido sulfhídrico, empleado como reactivo para la precipitación de los sulfuros.La reacción es exotérmica y para regular la producción de ácido sulfhídrico se empleaba un generador de Kipp, dispositivo que controlaba la reacción controlando la adición de ácido clorhídrico.
- Mediante reacción del sulfuro de aluminio con agua:
Al2S3 + 6 H2O → 3 ↑H2S + 2 Al(OH)3
- Mediante reacción de la tioacetamida con agua:
CH3C(S)NH2 + H2O → CH3C(O)NH2 + ↑H2S
La tioacetamida (CAS 62-55-5) se emplea como reactivo en química analítica para precipitación de muchos metales como sulfuros insolubles:
M2+ + CH3C(S)NH2 + H2O → ↓MS + CH3C(O)NH2 + 2 H+
- A partir del gas natural o del petróleo en los procesos industriales de éstos:
El gas natural o el gas asociado con el petróleo crudo es ácido, es decir, contiene cantidades variables de sulfuro de hidrógeno, desde trazas hasta un 70-80% en volumen. Este sulfuro de hidrógeno está casi siempre asociado con cantidades variables de dióxido de carbono. Los gases de refinería producidos en las unidades de hidrodesulfuración o craqueo tienen una proporción muy alta de sulfuro de hidrógeno frente al dióxido de carbono. Cuando el nivel de sulfuro de hidrógeno del gas alcanza cierto límite, es necesario un «endulzamiento» (sweetening) parcial o total (es decir, la eliminación del sulfuro de hidrógeno) para cumplir con los requisitos de transporte, distribución y contaminación del medioambiente.
El endulzamiento del gas se hace con el fin de eliminar el H2S y el CO2 del gas natural y permite obtener una mezcla de gas ácido de sulfuro de hidrógeno y dióxido de carbono que generalmente se utiliza para la recuperación de azufre mediante el proceso de Claus, pero también sirve como fuente de sulfuro de hidrógeno.
El gobierno estadounidense considera que el H2S es una amenaza química de alta prioridad tanto por su uso industrial como por su posible uso terrorista; su olor característico a huevos podridos es un arma de doble filo pues en concentraciones moderadas produce la parálisis de los nervios olfativos, engañando a la gente sobre su presencia9.
Si tenemos en cuenta los valores del peligro inmediato para la vida o la salud (IDLH, Immediately Dangerous to Life and Health), la toxicidad del sulfuro de hidrógeno (IDLH = 100 ppm) debería ser inferior a la del cianuro de hidrógeno (IDLH = 50 ppm)10,11.
Al igual que el cianuro, el H2S es un veneno celular que inhibe la citocromo C oxidasa interrumpiendo el transporte de electrones. De hecho se dice que es un inhibidor de la citocromo C oxidasa más potente que el cianuro. El resultado de la inhibición de la fosforilación oxidativa produce hipoxia celular y metabolismo anaerobio. El metabolismo anaerobio provoca una acidosis láctica. El H2S es un fuerte irritante respiratorio y reacciona con la humedad en la superficie de las membranas mucosas, formando sulfuro sódico9.
El olor característico, a huevos podridos, del sulfuro de hidrógeno permite su detección en concentraciones muy bajas, del orden de 0,008-0,1 ppm. Incluso a concentraciones del orden de 0,1 ppm se empieza a producir una cierta anosmia (pérdida del sentido del olfato) y a concentraciones superiores a 100 ppm no se puede percibir su olor, pues afecta al nervio olfativo. El valor del umbral de olor varía mucho según las personas y la pérdida del sentido del olfato a concentraciones elevadas puede crear en los afectados una falsa sensación de seguridad, cuando en realidad están en grave peligro9.
La tabla que se muestra a continuación resume algunos de los efectos producidos por diferentes concentraciones de sulfuro de hidrógeno9:
| Concentración (ppm) | Síntomas/Efectos |
| 0,01-1,5 | Umbral de olor (olor característico a huevos podridos). |
| 2-5 | La exposición prolongada puede provocar náuseas, lagrimeo de los ojos, dolores de cabeza o pérdida del sueño. En los pacientes con asma pueden aparecer problemas en las vías respiratorias (constricción bronquial). |
| 20 | Posible fatiga, pérdida de apetito, dolor de cabeza, irritabilidad, mala memoria o mareos. |
| 50-100 | Leve conjuntivitis e irritación de las vías respiratorias al cabo de 1 hora. Puede aparecer pérdida de apetito y malestar digestivo. |
| 100 | Tos, irritación de los ojos, pérdida del olfato (anosmia) al cabo de 2-15 minutos (fatiga olfativa). Alteración respiratoria, somnolencia al cabo de 15-30 minutos. Irritación de garganta al cabo de 1 hora. Agravamiento gradual de los síntomas al cabo de varias horas. La muerte puede ocurrir después de 48 horas. |
| 100-150 | Pérdida del olfato (fatiga olfativa o parálisis). |
| 200-300 | Después de 1 hora marcada conjuntivitis e irritación de las vías respiratorias. Puede aparecer edema pulmonar tras una exposición prolongada. |
| 500-700 | Tambaleo, colapso al cabo de 5 minutos. Daños graves en los ojos al cabo de 30 minutos. Muerte después de 30-60 minutos. |
| 700-1000 | Pérdida rápida del conocimiento, desmayo o colapso inmediato con tan solo 1 ó 2 inhalaciones, parada respiratoria, muerte al cabo de unos minutos. |
| 1000-2000 | Muerte casi instantánea. |
La exposición al sulfuro de hidrógeno por vía inhalatoria produce generalmente dolor de cabeza, náuseas, vértigo, mareos, debilidad, desorientación, hipotensión e irritación respiratoria. La lesión pulmonar puede progresar a lo largo de algunas horas. La intoxicación grave con sulfuro de hidrógeno puede causar inconsciencia, fallo respiratorio y cardiovascular. Es característico en exposiciones elevadas la pérdida rápida de la consciencia o «desmayo». Los pacientes que vuelven a despertarse pueden experimentar un síndrome confusional agudo, con agitación y confusión9.
La exposición de los ojos a bajas concentraciones de sulfuro de hidrógeno gas causa molestias por quemadura, parpadeo espasmódico o cierre involuntario de los párpados, enrojecimiento y lagrimeo. A altas concentraciones o exposiciones repetidas pueden aparecer opacidades en la córnea9.
Si la piel está mojada o húmeda el contacto con la piel del sulfuro de hidrógeno gas puede causar irritación y el contacto de la piel con sulfuro de hidrógeno líquido (licuado por presión) puede dar lugar a congelaciones9.
Si el paciente sobrevive las primeras 48 horas después de la exposición, es probable la recuperación. Después de una exposición aguda, la función pulmonar vuelve a su estado normal en 7-14 días9.
El «mubtakkar pestilente»
El «mubtakkar pestilente» sería, por analogía con el «mubtakkar», un pequeño dispositivo químico binario capaz de generar grandes cantidades de sulfuro de hidrógeno gaseoso. Los componentes de este dispositivo químico binario, contenidos en dos envases separados, no serían peligrosos por separado, pero una vez mezclados liberarían el sulfuro de hidrógeno.
El 4 de agosto de 2017 se informaba que la policía australiana había abortado un plan del Daesh para colocar un artefacto explosivo inprovisado (IED, Improvised Explosive Device) en el interior de un avión comercial, en el aeropuerto de Sidney. Habrían abortado también un segundo plan consistente en la liberación de sulfuro de hidrógeno en algún lugar público concurrido, mediante el empleo de un artefacto químico improvisado (ICD, Improvised Chemical Device). En la rueda de prensa de la policía australiana, sin precisar detalle alguno acerca de este segundo plan el portavoz de la policía señalaba que el sulfuro de hidrógeno es muy difícil de obtener y que aunque habían encontrado precursores químicos, los terroristas aún estaban muy lejos de disponer de un dispositivo funcional con el que llevar a cabo un atentado12,13,14,15,16,17.
Probablemente el principal problema para conseguir un «mubtakkar pestilente» operativo sea la elección de los componentes binarios.
Aunque en alguna página de internet podemos leer que «el sulfuro de alumino (CAS 1302-81-4) reacciona con agua para liberar sulfuro de hidrógeno y esta reacción es una forma barata y accesible de obtener sulfuro de hidrógeno»18, no parece que esto sea así, pues tratándose de un producto comercial su precio venta es de aproximadamente 248€/25g19, y su método de síntesis bastante complejo.
El sulfuro de aluminio se puede preparar directamente a partir de aluminio y azufre, en una reacción parecida a una «termita»20:
2 Al + 3 S → Al2S3
Cuando ambas sustancias finamente divididas se mezclan bien, y se calienta la mezcla, o el azufre se volatiliza (punto de fusión 115 °C y punto de ebullición 445 °C) sin que se produzca reacción alguna, o si la reacción se inicia resulta muy violenta y es difícil de controlar. Para evitar estos problemas se suele emplear como fuente de azufre el sulfuro de plomo (CAS 1314-87-0) por ser una sustancia muy poco volátil (1281 °C), que no puede escapar, y que reacciona de manera mucho menos violenta20:
2 Al + 3 PbS → Al2S3 + 3 Pb
Finalizada la reacción, al enfriar, solidifican los productos de reacción erro. Cuando los contenidos se han solidificado, el sulfuro de aluminio es resquebrajado del plomo, y se guarda protegido de la humedad20.
Otras posibles reacciones empleadas para la obtención del sulfuro de aluminio presentan bajos rendimientos21:
4 Al + 5 KSCN → 2 AlN + Al2S3 + 2 K2S + KCN + 4 C + ↑N2
4 Al + 3 CS2 + 3 ↑O2 → 3 ↑CO2 + 2 Al2S3
Los precursores más fáciles de obtener serían como en el caso del «mubtakkar», un sulfuro, por ejemplo sulfuro sódico (Na2S, CAS 1313-82-2) o sulfuro ferroso (FeS, CAS 1317-37-9) y ácido clorhídrico (HCl, CAS 7647-01-0). La reacción de estos componentes al entrar en contacto entre sí produciría el deseado sulfuro de hidrógeno:
Na2S + 2 HCl → 2 NaCl + ↑H2S
FeS + 2 HCl → FeCl2 + ↑H2S
Cualquiera de las dos reacciones podría ser empleada ya que los componentes binarios son de fácil obtención.
Referencias
- «Mubtakkar», https://en.wikipedia.org/wiki/Mubtakkar
- «Armas quimicas, la ciencia en manos del mal», Rene Pita, Plaza y Valdés Editores, 2008.
- «Assessing al-Qaeda’s Chemical Threat», René Pita, International Journal of Intelligence and CounterIntelligence, 20:3, 480-511, 2007
- «The one percent doctrine: deep inside America’s pursuit of its enemies since 9/11», Ron Suskind, Simon & Schuster, 2006.
- «Toxicology of Cyanides and Cyanogens: Experimental, Applied and Clinical Aspects», Alan H. Hall, Gary E. Isom & Gary A. Rockwood, John Wiley & Sons, 2015. Chapter 14. «Cyanide in chemical warfare and terrorism», René Pita.
- «Arsenic and old mustard: Chemical Problems in the Destruction of Old Arsenical and ‘Mustard’ Munitions», J.F. Bunnett & M. Mikolajczyk, Kluwer Academic Publishers,1998
- «Handbook of Chemical and Biological Warfare Agents», D. Hank Ellison, CRC Press, 2Ed, 2008
- Ullmann’s Encyclopedia of Industrial Chemistry,7th Ed.
- «Sulfuro de hidrógeno, para vivir y morir», J.Domingo, 17 noviembre 2017, https://cbrn.es/?p=1124
- «Hydrogen cyanide, SDS», Air Liquide, https://public.sitehawk.com/viewpdf.aspx?MaterialID=1811499&facilityID=1336&UseCatalog=True
- «Hydrogen sulfide, SDS», Air Liquide, https://public.sitehawk.com/viewpdf.aspx?MaterialID=1811456&facilityID=1336&UseCatalog=True
- «Australia confirma que Daesh planeaba atentar contra un avión en Sídney», https://www.abc.es/internacional/abci-australia-confirma-daesh-planeaba-atentar-contra-avion-sidney-201708040451_noticia.html
- «Australia confirma que el EI planeaba atentar contra un avión en Sídney», https://www.efe.com/efe/espana/mundo/australia-confirma-que-el-ei-planeaba-atentar-contra-un-avion-en-sidney/10001-3344060
- «Australia Details ‘Sophisticated’ Plot by ISIS to Take Down Plane», https://www.nytimes.com/2017/08/04/world/australia/sydney-airport-terror-plot-isis.html
- «Australia terror plot: Brother likely ‘had no idea’ bomb was in luggage, police say», http://www.foxnews.com/world/2017/08/04/australia-terror-plot-brother-likely-had-no-idea-bomb-was-in-luggage-police-say.html
- «Australian police charge two men over plane bomb plot», http://www.aljazeera.com/news/2017/08/australian-police-charge-men-plane-bomb-plot-170804003917635.html
- «Un alto comandante de ISIS dirigió el plan para atentar contra un avión en Australia», https://www.playgroundmag.net/now/atentado-avion-australia-isis_22450026.html
- «Aluminium sulfide», http://www.sciencemadness.org/smwiki/index.php/Aluminium_sulfide
- «Aluminium sulfide, granular, -4 mesh, 98%», Aldrich, ref. 333182 25g/248€, https://www.sigmaaldrich.com/catalog/product/aldrich/333182?lang=es®ion=ES
- Synthetic inorganic chemistry-a course of laboratory and classroom study for first year college students-A. A. Blanchard, J. W. Phelan & A. R. Davis, J.Wiley, 1936
- «Die Bindung von Stickstoff und Schwefel durch einige Leichtmetalle und -carbide in Rhodankaliumschmelzen», Ernst Biesalski & Hendrik Van Eck, Z. Anorg. Allg. Chem., 156: 226-236, (1926).